吖啶橙荧光染色观察细胞形态-吖啶橙染色法优缺点
用作荧光指示剂,肿瘤细胞及细菌、核酸染色剂及移码突变的诱变剂。
吖啶橙是一种荧光色素,吖啶橙激发滤光片波长488nm。阻断滤光片波长515nm。吖啶橙与细胞中DNA和RNA结合量存在差别,可发出不同颜色的荧光(即着色特异性),这是由于DNA是个高度聚合物,吸收荧光物质的位置较少,发绿色荧光,而RNA聚合度低,能和荧光物质结合的位置多,故发红色荧光。
吖啶橙对细胞染色的影响,能够对哪些细胞进行染色
吖啶橙本身就是单一的分子,你说的是吖啶橙细胞染色的方法吧:
1.PBS洗盖玻片3次。
2. 再在冷的Carnoy's中固定10min
3.用Mcllvaine's 洗3次,每次5min
4.用Mcllvaine's将1%吖啶橙稀释为1:100
5.用0.01%吖啶橙染色盖玻片5min
6.在缓冲液中冲洗盖玻片5min
7.将盖玻片用缓冲液封固于载玻片上
8.用低倍和高倍物镜在荧光镜下观察。
吖啶橙染色怎么用于细胞自噬
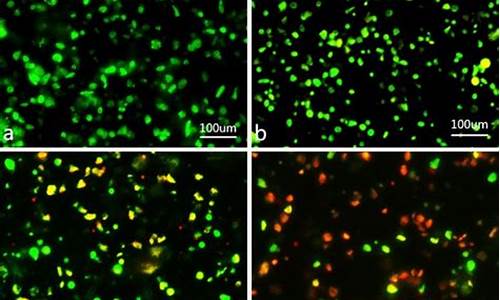
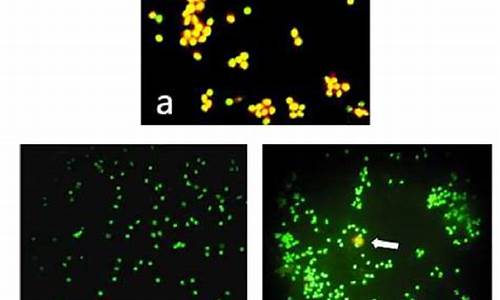
荧光显微镜下观察:凋亡细胞体积缩小,呈现核固缩,沿核膜呈点状、新月状或杆状,镜下可见四种细胞形态:活细胞,核染色质着绿色并呈正常结构;早期凋亡细胞,核染色质着绿色但呈固缩状;非凋亡的亡细胞,核染色质着橘红色并呈正常结构;晚期凋亡细胞,核染色质着橘红色但呈固缩状。因为有早期凋亡(绿色)和晚期凋亡细胞(橘红色)!
跑凝胶电泳指示剂加的太少影响吗
细胞自噬预实验
化学染色法
1、 试验目的
通过化学染料吖啶橙(acridine orange,AO)染色木犀草素处理后的HepG2细胞判断木犀草素是否诱导HepG2细胞发生自噬。
2、 试验原理
3,6-(二甲胺基)吖啶盐酸盐,分子式C17H19N3 · HCl · ZnCl2, 分子量438.12g/mol,是一种荧光色素,其检测激发滤光片波长488nm,阻断滤光片波长515nm。它与细胞中DNA和RNA结合量存在差别,可发出不同颜色的荧光,与DNA结合量少发绿色荧光,与RNA结合量多发桔**或桔红色荧光。该染料具有膜通透性,能透过细胞膜,使核DNA和RNA染色。AO也可以渗透进入酸性细胞器,例如自噬溶酶体,发生自噬的细胞经吖啶橙染色,在荧光显微镜下可观察到红**点状体,称为酸性小体,当PH值较低的时候,AO发出红色荧光,且强度与酸性程度相关。所以在AO标记的细胞中,酸性囊泡细胞器结构可以通过荧光显微镜下观察到。
现在常用的核酸染料有哪几种
电泳后,核酸需经染色才能显色出带型,常用以下核酸染色剂: 1、溴化乙锭(ethidium bromide,EB)最常用的核酸荧光染料,可嵌入核酸双链的配对碱基之间,在紫外线激发下,发出桔红色荧光.EB-DNA复合物中的EB发出的荧光,比游离的凝胶中的EB发出的荧光强度大10倍,因此无需洗净背景即可清楚观察核酸带型.若EB背景太深,可将凝胶 浸泡于1mmol/LMgSO4中1h或10mmol/L MgCl2中5min,使非结合的EB褪色,这 样可检查到10ng的DNA样品,EB也可用于检测单链DNA或RNA,但其对单链核酸的亲和力相对较小,荧光产率也相对较低. 在凝胶或电泳缓冲液中加入终浓度为0.5μg/ml的EB,染色可在电泳过程中进行,能随时观察核酸的迁移情况.但EB带正电荷,嵌入碱基后增加了 核酸分子的刚性,使迁移率减慢,故不宜用于测定核酸分子量的大小,这时应在电泳后将凝胶浸入0.5μg/ml的EB水溶液中10min进行染色.EB见光 易分解,应于4℃避光保存, 2、吖啶橙(acridine orange,AO):吖啶橙可嵌入双链核酸碱基对之间,在254nm紫外线激发下发出530nm的绿色荧光;还通过静电与单链核酸的磷酸基结合,在254nm紫外线激发 下产生640nm的红色荧光.因此可区分单链和双链核酸,灵敏度分别为0.1μg和0.05μg.但吖啶橙的染色操作要求严格,应在 22℃,0.01mol/L磷酸钠缓冲液(pH7.0)中避光浸泡30min,然后在搪瓷盘中用该缓冲剂4℃脱色过夜或22℃脱色1~2小时. 3、银(Ag+)试剂: Ag+与核酸形成稳定复合物,然后用甲醛使Ag+还原成银颗粒.AgNO3等试剂可使聚丙烯酰胺凝胶上的单链,双链DNA及 RNA都染成黑褐色.银染法的灵敏度比EB染色高200倍左右,比亚甲蓝染色高100~1000倍,在小于0.5mm厚的凝胶中,能检测出0.5ng的 RNA,其缺点是专一性不强,能与蛋白质,去污剂反应也产生褐色,而且对DNA的染色定量不准确.银与DNA稳定结合,对DNA有破坏作用,不适于DNA 片段回收的制备. 4、亚甲蓝(methylene blue)可将RNA染成蓝色,但灵敏度不高,而且操作时间长.胶浸泡于0.02%的亚甲蓝,10mmol/L Tris-Ac(pH8.3),4℃放置1~2h,用净水洗5~8h(反复换水),带型肉眼可见,最低检测量为 250ng.
核酸电泳染色剂有哪些
常用的核酸染料有:
1、EB染料
EB属于核酸分子嵌入剂,通常用于分子遗传学、DNA和染色质结构分析等研究中,特别是国内很多实验室仍在使用EB进行凝胶核酸电泳实验的染色。
EB是极易渗透细胞膜与胞内DNA嵌合的小分子,它具有平面共轭大环结构,是典型的DNA分子插入试剂,菲啶环插入到DNA分子的碱基对之间,与DNA嵌合形成稳定的复合物,并影响DNA
的复制,破坏正常的遗传生理现象。EB作为诱变性的化合物,它在人体中诱导突变的机制是不可逆转的。
2、GoldView染料
GoldView(GV)是一种可代替溴化乙锭(EB)的新型核酸染料,其灵敏度与EB相当,使用方法与之完全相同。在紫外透射光下双链DNA呈现绿色荧光,也可用于RNA染色。
实质上,所谓的Goldview就是吖啶橙,也就是传说中的AO,有一种传统的细胞凋亡试验,采用的染料正是吖啶橙,也就是AO/EB染色试验,EB无法穿透完整的细胞膜,而AO可以穿过细胞膜染上细胞核,以此来区分凋亡和未凋亡的细胞。
3、GelRed 和 GelGreen染料
GelRed
和GelGreen
是两种集高灵敏、低毒性和超稳定于一身的极佳的荧光核酸凝胶染色试剂。其水溶染色剂通过美国环保局安全认定,废弃物可直接倒入下水道,而不会造成任何环境污染。
GelRed
和 GelGreen
的特殊化学结构使其难以穿透细胞膜进入细胞,正是这一特性降低了染料的细胞毒性。不过也正是因为如此,其价格大约是GoldView的十倍左右。
扩展资料
核酸染料的科研应用:
1、免疫分析
荧光标记的单克隆抗体技术为流式细胞仪在研究细胞膜和细胞内各种功能性抗原、肿瘤基因蛋白等领域扩展了无限的应用空间。
荧光探针可以通过蛋白质交联剂共价结合在单克隆抗体上。免疫荧光标记最常用的染料有异硫氰酸荧光素(fluorescein isothiocyanate, FITC)、藻红蛋白(PE)以及AlexaFluor系列染料等。
2、核酸检测
核酸荧光染料对细胞核染色后定量测量细胞所发出的荧光强度,就可以确定细胞核中DNA、RNA的含量,并可以对细胞周期和细胞的增殖状况进行分析。
有多种荧光染料可以对细胞中的DNA或RNA染色,常用的DNA染料包括碘化丙啶(PI)、DAPI、Hoechst 33342等,RNA染料有噻唑橙、吖啶橙等。
百度百科-荧光染料
电泳后,核酸需经染色才能显色出带型,常用以下核酸染色剂:
1、溴化乙锭(ethidium bromide, EB)
最常用的核酸荧光染料,可嵌入核酸双链的配对碱基之间,在紫外线激发下,发出桔红色荧光。 EB-DNA复合物中的EB发出的荧光,比游离的凝胶中的EB发出的荧光强度大10倍,因此无需洗净背景即可清楚观察核酸带型。若EB背景太深,可将凝胶 浸泡于1mmol/LMgSO4中1h或10mmol/L MgCl2中5min,使非结合的EB褪色,这 样可检查到10ng的DNA样品,EB也可用于检测单链DNA或RNA,但其对单链核酸的亲和力相对较小,荧光产率也相对较低。
在凝胶或电泳缓冲液中加入终浓度为0.5μg/ml的EB,染色可在电泳过程中进行,能随时观察核酸的迁移情况。但EB带正电荷,嵌入碱基后增加了 核酸分子的刚性,使迁移率减慢,故不宜用于测定核酸分子量的大小,这时应在电泳后将凝胶浸入0.5μg/ml的EB水溶液中10min进行染色。EB见光 易分解,应于4℃避光保存,
2、吖啶橙(acridine orange, AO):
吖啶橙可嵌入双链核酸碱基对之间,在254nm紫外线激发下发出530nm的绿色荧光;还通过静电与单链核酸的磷酸基结合,在254nm紫外线激发 下产生640nm的红色荧光。因此可区分单链和双链核酸,灵敏度分别为0.1μg和0.05μg。但吖啶橙的染色操作要求严格,应在 22℃,0.01mol/L磷酸钠缓冲液(pH7.0)中避光浸泡30min,然后在搪瓷盘中用该缓冲剂4℃脱色过夜或22℃脱色1~2小时。
3、银(Ag+)试剂:
Ag+与核酸形成稳定复合物,然后用甲醛使Ag+还原成银颗粒。AgNO3等试剂可使聚丙烯酰胺凝胶上的单链,双链DNA及 RNA都染成黑褐色。银染法的灵敏度比EB染色高200倍左右,比亚甲蓝染色高100~1000倍,在小于0.5mm厚的凝胶中,能检测出0.5ng的 RNA,其缺点是专一性不强,能与蛋白质,去污剂反应也产生褐色,而且对DNA的染色定量不准确。银与DNA稳定结合,对DNA有破坏作用,不适于DNA 片段回收的制备。
4、亚甲蓝(methylene blue)
可将RNA染成蓝色,但灵敏度不高,而且操作时间长。染色过程:胶浸泡于0.02%的亚甲蓝,10mmol/L Tris-Ac(pH8.3),4℃放置1~2h,用净水洗5~8h(反复换水),带型肉眼可见,最低检测量为 250ng。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。