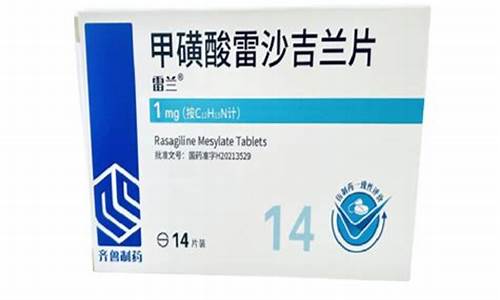
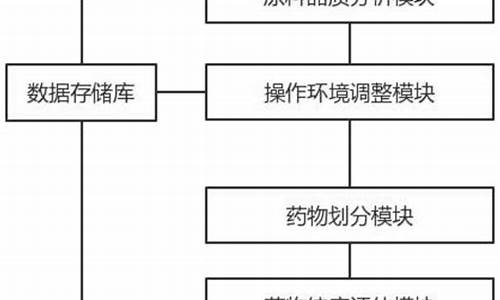
查询原料药登记信息的方法-如何查原料药生产企业

原料药从生产转移研究、注册申报、审评审批,只需要6个月时间
中关村:北京华素制药在河北沧州临港经济技术开发区建设的沧州分公司属于分公司,按北京市药品监管政策同属北京市药监局监管,该分公司药品生产许可证变更项目为“增加生产地址和范围”,并取得药品生产许可证,可进行原料药相关转移工作,我公司按原工艺进行转移,依据要求完成工艺验证及稳定性研究等工作即可申报,获得审批后正式生产供货,按此流程基本需要6个月左右。
原料药批件没有标记规格,登记号可以就一个规格吗
药品国家编码如下:
1、国际非专利药物名称(INN):这是由世界卫生组织(WHO)制定的全球通用的药物命名系统。INN是一个标准化的药物命名,用于识别药物的活性成分。每个活性成分都有一个独特的INN,以确保全球范围内的一致性和交流。例如,对乙酰氨基酚是对应的INN,它是常见的退烧镇痛药物的活性成分。
2、国家药品编码(NDC):这是由美国食品和药物管理局(FDA)制定的用于标识和追踪药物的编码系统。NDC是一个12位数字编码,用于唯一识别药物的厂商、产品和包装规格。NDC包含三个部分:厂商代码、产品代码和包装规格代码。NDC在美国的药品市场中具有重要的作用,用于药物的分类、分销和报销等方面。所以,药品国家编码如上述所示。
原料药里的CAS是什么意思
可以。
原料药批件没有标记规格由相关规定来看,登记号可以就一个规格,但是不同的包装和规格上农药标签的内容应是一样的,并且要符合登记内容。
原料药,指用于生产各类制剂的原料药物,是制剂中的有效成份,由化学合成、植物提取或者生物技术所制备的各种用来作为药用的粉末、结晶、浸膏等,但病人无法直接服用的物质。
原料药登记的A和A*表示什么
出运危品的话需要这个,是物质的理化常数的其中一项.
比如:氰氨化钙,它的CAS NO.号是:156-62-7
CAS号(Chemical Abstracts Service)是美国化学文摘登记号,该号是用来判定检索有多个名称的化学物质信息的重要工具。
What is CAS?
A. CAS (Chemical Abstracts Service) is a division of the American Chemical Society. We are located in Columbus, Ohio. CAS is the producer of the largest and most comprehensive databases of chemical information. Our principal databases are Chemical Abstracts (CA) which contains over 23 million document records from the chemical journal and patent literature, and Registry which contains over 24 million substance and 50 million sequence records
CAS also operates the STN International online service with partner organizations in Europe and Asia. STN provides access to nearly 200 databases covering topics such as science, technology, patents, and business information.
怎样查询原料药在欧盟递交了dmf
1、A表示已批准在上市制剂使用的原料,辅料,包材。
2、A星表示单独申报且已通过技术审评,但尚未通过与制剂共同审评审批的原料,辅料,包材。以上是原料药登记的A和A星表示的含义。
获得FDA认证的程序
对于原料药来说,通过FDA批准主要有两个阶段:一是DMF文件的登记,要求递交的DMF文件对所申请的药品的生产和质量管理的全过程以及药品质量本身做一个详尽的描述。FDA要为此文件保密,该文件是由FDA的药物评价及研究中心(Center for Drug Evaluation and Research, CDER)来审核。二是当DMF文件的登记已经完成,而且在美国的原料药品终端用户提出了申请以后,FDA官员对原料药物的生产厂家进行GMP符合性现场检查,通过对药品生产全过程的生产管理和质量管理状况的全面考察,做出该原料药生产企业的生产和质量管理能否确保所生产药品的质量的判断。FDA在现场检查的基础上做出是否批准该原料药品在美国市场上市的决定。
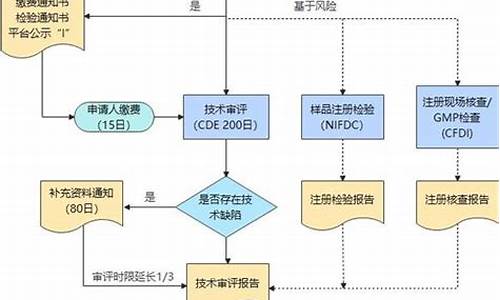
其基本程序如下所示:
1.进行国际市场调研,摸清美国市场目前的销售情况,对市场发展趋势与走向做出正确的预测、分析和判断,选择好申请FDA批准的品种。
2.选择申请代理人和代理经销商,并签订委托协议书、签署委托书。
3.编写申请文件,原料药为DMF文件,由代理人完成申请文件终稿的编写并向FDA递交,取得DMF文件登记号。
4.FDA收到申请文件后,经初审合格后发通知函给申请人,并发给一个登记号,说明DMF文件持有人的责任和义务。
5.工厂按美国cGMP的要求进行厂房、设施设备的改造和并完善生产质量管理的各项软件和相关人员的强化培训。
6.应美国制剂生产厂家(即该原料药品的终端用户)的申请, FDA派官员到生产厂家按照FDA颁布的生产现场检查指南并对照已上报审核的DMF文件进行检查,FDA官员在生产现场的基础上出具书面意见给生产厂家并向FDA报告检查结果。
7.FDA审核批准后将审核结果通知生产厂家并输入美国海关的管理系统,该原料药品即获准直接进入美国市场。
8.生产厂家每年向FDA递交一份DMF修改材料,一般情况下, 每2~3年可能要接受一次复查。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。