原料药合成路线的一般选择原则-原料药合成路线
化学药物合成路线设计方法不包括:(C)。
A、类型反应法。
B、分子对称法。
C、直接合成法。
D、追溯求源法。
常见化学合成药物:
指以结构较简单的化合物或具有一定基本结构的天然产物为原料,经过一系列反应过程制得的对人体具有预防、治疗及诊断作用的原料药。这些药物都是具有单一的化学结构的纯物质。化学合成药的发展已有一百多年历史。
19世纪40年代,、氯仿等在外科和牙科手术中的成功应用,标志着化学合成药在医疗史上的出现。随着有机化学、药理学和化学工业的发展,化学合成药发展迅速,品种、产量、产值等均在制药工业中占首要地位。世界上临床使用的化学合成药物品种已多达数千种。
生产方法化学合成药的生产绝大多数采用间歇法, 大致分为三种:
①全化学合成,大多数化学合成药是用基本化工原料和化工产品经各种不同的化学反应制得,如磺胺药、各种解热镇痛药。
②半合成,部分化学合成药是以具有一定基本结构的天然产物作为中间体进行化学加工,制得如甾体激素类(见激素)、半合成抗生素。
③化学合成结合微生物合成,此法可使许多药品的生产过程更为经济合理,例如维生素C、甾体激素和氨基酸等的合成。
常见化学合成药物的起源:
自19世纪至20世纪30年代。其特征是从动植物体中分离、纯化和鉴定许多天然产物,如有机酸(如水杨酸)、生物碱(如吗啡、阿托品、奎宁、咖啡因)等。这些天然产物具有某种生理或药理活性,可直接被用作药物。
它们的分离和鉴定,说明了天然药物巾所含的化学物质是天然药物产生治疗作用的物质基础,这些天然药物分子不仅为临床应用提供了准确适用的药品,而且也为药物化学的发展创立了良好的开端。
19世纪中期以后,化学工业,特别是染料化工、煤化工等的发展,为人们提供了更多的化学物质和原料,人们对众多的有机合成化学的中间体、产物等进行了药理活性研究。同时有机合成技术的发展,使人们由简单的化工原料来合成药物成为可能。
如人们使用氯仿和作为全身,水合氯醛作为镇静夜眠药,这些药品的成功使用,促进了制药工业的发展。
化学药物从实验室开发到工业生产一般要经过哪些主要过程和阶段
正是基于以上一些考虑,国外药政管理当局在审评原料药的制备工艺资料时,均对其合成路线的长短有所要求。例如,FDA要求合成原料药的反应步数至少应为三步。欧盟要求至少有一步化学反应(不包括成盐或精制)是在申报的企业生产,并且要在起始原料中确定一个关键原料,该原料也应在符合GMP条件的车间进行生产。一般而言,合成原料药的制备工艺应该从该药品的主结构开始形成之前的原料开始申报。
版主,你好!这段话出自FDA和欧盟那个文件,我很想找到根据
稳定性试验包括哪些
1、 新药研发的探索阶段:实验室研究
该阶段会采用反复分馏、多次重结晶、各种层析技术等一切分离纯化手段,来制备少量的样品供药理筛选,很明显这样的合成方法与工业生产的差距很大。实验室研究阶段在化学药研发流程中比较重要,这阶段的主要任务有:
(1)了解合成路线是否存在知识产权问题、生产成本能否接受;
(2)合理设计化合物尽快完成该化合物的合成;
(3)采取各种手段,确证化合物的化学结构;
(4)测定化合物的主要物理参数;
(5)对化合物的合成方法不作过多的研究,只需要了解化合物的一般性质。
2、小量试制阶段
新药苗头确定后,要进行小试研究,小试阶段的主要任务是对实验室原有的合成路线和方法进行全面、系统的改革,在改革的基础上通过实验室批量合成、积累数据,提出一条基本适合中试生产的合成工艺路线。
为了研究确定一条最佳的合成工艺路线需要做到:
(1)通过小试研究改掉实验室的那些不符合工业生产的合成步骤和方法;
(2)在小试阶段需要探明用工业级原料和溶剂对反应有无干扰,对产品的产率和质量有无影响;通过小试研究找出适合于用工业级原料生产的最佳反应条件和处理方法,达到价廉、优质和高产;
(3)通过小试找出原料和溶剂的回收套用方法,降低生产成本;
(4)通过小试研究尽量去掉有毒物质和有害气体参与的合成反应,选择工艺路线时要考虑三废问题。
3、 中试生产阶段
根据小试实验研究工业化可行的方案,进一步研究在一定规模的装置中各步化学反应条件的变化规律,并解决实验室所不能解决或发现的问题,为工业化生产提供设计依据。
原料药中试生产也是原料药小试生产的扩大,中试生产的主要任务有以下几点:
(1)验证小试工艺路线是否符合工业化生产条件
考核小试提供的合成工艺路线,在工艺条件、设备、原材料等方面是否有特殊要求,是否适合于工业生产。一个合格的工艺应当能够稳定、连续地生产出符合质量要求的产品。
(2)验证小试工艺路线的经济性
验证小试提供的合成工艺路线,是否成熟、合理,主要经济技术指标是否接近生产要求;
在放大中试研究过程中,进一步考核和完善工艺路线,对每一反应步骤和单元操作,均应取得基本稳定的数据。
(3)原料药、中间体和产品的质量控制
根据中试研究的结果制订中间体和成品的质量标准,以及分析鉴定方法。
(4)确定中试工艺参数
制备中间体及成品的批次一般不少于3-5批,以便积累数据,完善中试生产资料,为正式生产提供数据。工艺数据的积累至少具有两方面的意义:一方面有助于判断工艺的可行性、稳定性与产品质量的重现性之间的联系,另一方面有助于过程控制方法和终点检验标准的建立。
(5)进行生产成本的核算
根据原材料、动力消耗和工时等,初步进行经济技术指标的核算,提出生产成本,为正式生产提供最佳物料量和物料消耗。
(6)回收和套用试剂,并处理三废
对各步物料进行步规划,提出回收套用和三废处理的措施。
(7)建立中试工艺规程
提出整个合成路线的工艺流程,各个单元操作的工艺规程,安全操作要求及制度。
中试平台是药品产业化的孵化器,在科研和生产之间起着纽带的作用,与药品生产企业有着密不可分的关联。中试平台实施GMP管理,为产业化提供了完善的产品标准和工艺规程,解决了规模生产的关键技术,对于中试平台规划化管理、促进产品的可生产性、提高产品转化率、保证产品质量等方面都有着非常重要的意义。
4、工业化生产阶段
原料药的工业化生产,其重要的目的主要有两个,一是用于相应的制剂生产,二是以原料药及化工原料的形式进行国内外销售。在将工艺由实验室转向工厂、将样品转化成产品的过程中,最关键的阶段无外乎路线优化阶段,这是成功转向生产的基石。
医药数据库在药物研发中的作用?
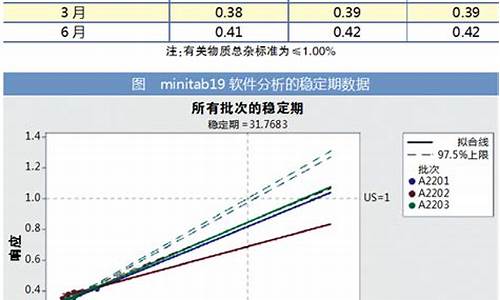
稳定性试验包括:影响因素试验、加速试验与长期试验、供试品要求、研究药物稳定性。
1、影响因素试验:
影响因素试验是一种用于评估药品在各种环境因素影响下稳定性的试验方法。它适用于在原料药和药物制剂处方筛选过程中的稳定性考察。在该试验中,只需使用一批原料药进行测试,以了解药品在不同条件下的稳定性表现。
通过这种试验,可以筛选出更具有稳定性的药物处方,为后续的药品研发和生产提供重要依据。
2、加速试验与长期试验:
加速试验和长期试验是药物稳定性研究中非常重要的实验,适用于原料药和药物制剂。在这两种实验中,都需要使用三批供试品进行测试,以更准确地评估药品的稳定性和有效期。
3、供试品要求:
在稳定性试验中,对供试品有一些具体要求。对于原料药,供试品的合成工艺路线、方法、步骤应与大生产一致。这意味着在稳定性试验中,应使用与实际生产中采用的合成工艺相同的方法和步骤来制备供试品。
这样可以保证稳定性试验结果的一致性和可比较性,从而更好地指导工业化生产过程中的质量控制和优化。应是一定规模生产的,原料药合成工艺路线、方法、步骤应与大生产一致。对于药物制剂,供试品应是一定规模生产的,其处方与生产工艺应与大生产一致。
4、研究药物稳定性:
在研究药物稳定性时,需要采用专属性强、准确、精密、灵敏的药物分析方法与分解产物检查方法,以确保稳定性结果的可靠性。这些方法应该经过充分的验证,以证明其有效性、准确性和可靠性。
此外,在稳定性研究中,应考虑到温度、湿度、光照等因素对药物稳定性的影响,同时还需要了解药物在不同环境条件下的变化情况。
化学药与生物药如何区分?
数据库和医药行业是一个密不可分的话题,很多药企可以通过数据数据库,分析市场药品需求,确定药物研发方向,在开发过程中可以准确地查询筛选靶点物质,还能查询药物毒理数据,也解决了以前临床样本小,采样分布有限的问题,有效地提升了药物研发的效率。
医药大数据对于药物研发的作用
在大数据未成熟之前,药企在研发新药时,最多的就是资料的查询如:靶点的查询,文献的查询,临床数据的查询,除了查询这些数据,还要忍受大量的候选药物的折磨,而且对于市场的回报有着不确切性,风险很大,研发时间也要长达十几二十年,对比现在医药大数据对于药物研发提高了时间效率,还能预测回报,规避风险。
药物研发的作用
医药大数据不仅对于研发有很大的作用,对于申报注册、投资、项目立项、市场调研、竞品分析、专利分析等都有帮助,查询靶点信息,药物毒理信息解决药物研发中出现的问题,简单介绍一研发步骤以及数据库解决的问题。
1、靶点的筛选
药物研发需要查询筛选靶点物质,海量的数据需要花费时间和精力,在大数据查询选定了药物靶点,之后找寻靶标有作用的化合物,以他们的化合物作为先导设计出更优秀的化合物,在满足生物活性最优化合物之后,就可以进入研发了。
靶点的筛选
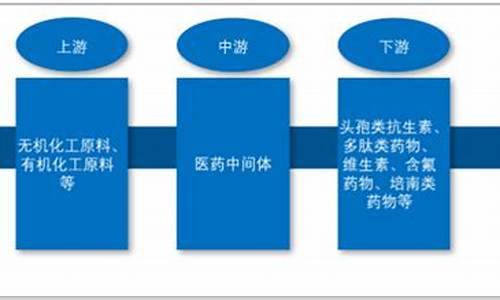
2、原料药合成工艺
药物研发的第一步骤就是原料药合成工艺,在医药大数据中筛选出原料药选择最优的合成路线。
原料药合成工艺
3、药理毒理的数据研究
新药研究和开放处于药物研发的早期阶段,在这个阶段对具有良好前景的新药的潜在毒性发现得越早,该药物研发的成功率也就越高。
(1)通过早期毒性优化筛选,筛选出更合适研发的化合物,可提高候选药物的质量,并减少药物开发循环的时间;
(2)通过对基因表达、蛋白质和代谢产物数据系统性分析,建立更加适合于毒性预测的动物模型;
(3)选择更精确的剂量和确定安全域MOS;
(4)新的毒理学生物标志物可提高临床实验中的决策率;
(5)根据毒理基因学的基因标志物将允许在后期研究和投放市场时选择最合适的病人群体,满足个体化治疗的需要。
药理毒理
4、临床的研究
临床试验分为(Ⅰ-Ⅳ)期,临床研究Ⅰ-Ⅲ期没有问题,就可以审批上市,上市之后的监测也成为第Ⅳ期临床研究,临床研究是了解药物安全性,有效性,药物的优势越好,那么药物的市场也大。
临床研究数据
做药物研发之前还会通过大数据技术对于市场做分析,对于公共疾病和药品的需求为药物研发合理安排时间,在我们企业首先会看市场,看市场的需求,受众是否广泛,这些都离不开医药大数据的,还有在医药副作用研究方面可以通过药物毒理了解药物副作用情况,医药大数据不仅对于药物研发有很大的帮助,还对于预测市场,药品销售、产品定位都有非常大的帮助。
化学药是通过人工的工艺路线设计,在反应釜中加入基础化合物(如甲烷、乙烷、甲苯、醋酸、甲醇、乙醇等等)基础原料进行化学反应合成出来的药物;
而生物药则指的是培养微生物菌种,并将菌种扩大化,在适宜的温度、压力、氧气等条件下,加入营养液,促使微生物菌群发酵产生的代谢物,这一类具有治疗作用的化学物质就叫生物药。
扩展资料
药品
根据《中华人民共和国药品管理法》第一百零二条关于药品的定义:药品是指用于预防、治疗、诊断人的疾病,有目的地调节人的生理机能并规定有适应症或者功能主治、用法和用量的物质,包括中药材、中药饮片、中成药、化学原料药及其制剂、抗生素、生化药品、放射品、血清、疫苗、血液制品和诊断药品等。
2013年1月,国家发展和改革委员会发出通知,决定从2013年2月1日起调整呼吸、解热镇痛和专科特殊用药等药品的最高零售限价,共涉及20类药品,400多个品种、700多个代表剂型规格,平均降价幅度为15%,其中高价药品平均降幅达到20%。
特性介绍
从使用对象上说:它是以人为使用对象,预防、治疗、诊断人的疾病。有目的地调节人的生理机能,有规定的适用症、用法和用量要求;从使用方法上说:除外观,患者无法辨认其内在质量,许多药品需要在医生的指导下使用,而不由患者选择决定。同时,药品的使用方法、数量、时间等多种因素在很大程度上决定其使用效果,误用不仅不能“治病”,还可能“致病”,甚至危及生命安全。因此,药品是一种特殊的商品。
1、种类复杂性:具体品种,全世界大约有20000余种,我国中药制剂约5000多种,西药制剂约4000多种,由此可见,药品的种类复杂、品种繁多。
2、药品的医用专属性:药品不是一种独立的商品,它与医学紧密结合,相辅相成。患者只有通过医生的检查诊断,并在医生与执业药师的指导下合理用药,才能达到防止疾病、保护健康的目的。
3、药品质量的严格性:药品直接关系到人们的身体健康甚至生命存亡,因此,其质量不得有半点马虎。我们必须确保药品的安全、有效、均一、稳定。
另外,药品的质量还有显著的特点:它不像其他商品一样,有质量等级之分:优等品、一等品、二等品、合格品等等,都可以销售,而药品只有符合规定与不符合规定之分,只有符合规定的产品才能允许销售,否则不得销售。
管理规范
药品质量符合规定不仅是产品质量符合注册质量标准,还应使其全过程符合《药品生产质量管理规范》(简称GMP)。
《药品生产质量管理规范》(Good Manufacture Practice,GMP)是药品生产和质量管理的基本准则,适用于药品制剂生产的全过程和原料药生产中影响成品质量的关键工序。大力推行药品GMP,是为了最大限度地避免药品生产过程中的污染和交叉污染,降低各种差错的发生,是提高药品质量的重要措施。
参考资料来源:百度百科-药品
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。