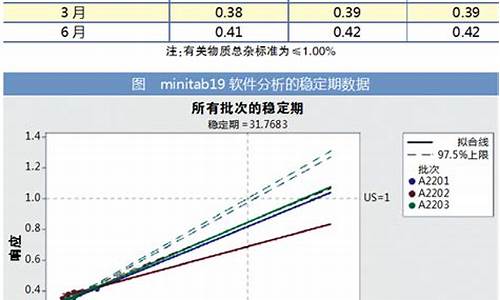
原料药生产批次的划分原则-原料药批号编制原则

第一章 总则一、总则
1、本附录为《兽药生产质量管理规范》对无菌兽药、非无菌兽药、原料药、兽用生物制品、预混剂、中药制剂等生产和质量管理特殊要求的补充规定。
2、兽药生产洁净室(区)的空气洁净度划分为四个级别:
洁净度级别 尘粒最大允许数/立方米 微生物最大允许数 换气次数
(静态) (静态)
≥0.5μm ≥5μm 浮游菌/立方米 沉降菌/Ф90皿0.5h
100级 3500 0 5 0.5 附注2
10000级 350000 2000 50 1.5 ≥20次/时
100000级 3500000 20000 150 3 ≥15次/时
300000级 10500000 60000 200 5 ≥10次/时
注:(1)尘埃粒子数/立方米,要求对≥0.5μm和≥5μm的尘粒均测定,浮游菌/立方米和沉降菌/皿,可任测一种。
(2)100级洁净室(区)0.8米高的工作区的截面最低风速:垂直单向流0.25米/秒;水平单向流0.35米/秒。
(3)洁净室的测定参照JGJ71-90《洁净室施工及验收规范》执行。
3.洁净室(区)的管理需符合下列要求:
(1)洁净室(区)内人员数量应严格控制,对进入洁净室(区)的临时外来人员应进行指导和监督。
(2)洁净室(区)与非洁净室(区)之间必须设置缓冲设施,人、物流走向合理。
(3)100级洁净室(区)内不得设置地漏,操作人员不应裸手操作,手部应及时消毒。
(4)传输设备不应在10000级的强毒、活毒生物洁净室(区)以及强致敏性洁净室(区)与低级别的洁净室(区)之间穿越,传输设备的洞口应保证气流从相对正压侧流向相对负压侧。
(5)100000级及其以上区域的洁净工作服应在洁净室(区)内洗涤、干燥、整理,必要时应按要求灭菌。
(6)洁净室(区)内设备保温层表面应平整、光洁,不得有颗粒性物质脱落。
(7)洁净室(区)鉴定或验收检测,要求两种粒径的尘埃粒子数以及浮游菌数或沉降菌中任一种结果均必须符合静态条件下的规定数值,此外还应定期监测动态条件下的洁净状况。
(8)洁净室(区)的净化空气如可循环使用,应采取有效措施避免污染和交叉污染。
(9)洁净室(区)的噪声不应高于60分贝(A),其中局部100级的房间宜不高于63分贝(A),局部百级区和全室100级的房间应不高于65分贝(A)。
(10)洁净室的换气次数和工作区截面风速,一般应不超过其级别规定的换气次数和截面风速的130%,特殊情况下应按设计结果选用。
(11)空气净化系统应按规定清洁、维修、保养并作记录。
4、兽药生产过程的验证内容必须包括:
(1)空气净化系统
(2)工艺用水系统
(3)工艺用气系统
(4)生产工艺及其变更
(5)设备清洗
(6)主要原辅材料变更
无菌兽药生产过程的验证内容还应增加:
(1)灭菌设备
(2)药液滤过及灌封(分装)系统
5.水处理及其配套系统的设计、安装和维护应能确保供水达到设定的质量标准
6.印有与标签内容相同的兽药包装物,应按标签管理。
7、兽药零头包装只限两个批号为一个合箱,合箱外应标明全部批号,并建立合箱记录。
8.兽药放行前应由质量管理部门对有关记录进行审核,审核内容应包括:配料、称重过程中的复核情况;各生产工序检查记录;清场记录;中间产品质量检验结果;偏差处理;成品检验结果等。符合要求并有审核人员签字后方可放行。二、无菌兽药
无菌兽药是指法定兽药标准中列有无菌检查项目的制剂。
1、无菌兽药生产环境的空气洁净度级别要求:
(1)最终灭菌兽药
10000级背景下的局部100级:大容量静脉注射剂(≥50毫升)的灌封;
10000级:注射剂的稀配、滤过;
大容量非静脉注射剂和小容量注射剂的灌封;
直接接触兽药的包装材料最终处理后的暴露环境;
100000级:注射剂浓配或采用密闭系统的稀配;
直接接触兽药的包装材料的最后一次精洗。
(2)非最终灭菌兽药
10000级背景下局部100级:灌装前不需除菌滤过的药液配制;
注射剂的灌封、分装和压塞;
直接接触兽药的包装材料最终处理后的暴露环境。
10000级:灌装前需除菌滤过的药液配制。
100000级:轧盖,直接接触兽药的包装材料精洗的最低要求。
(3)其它无菌兽药
2、无菌灌装设备应定期用微生物学方法检查,并定期验证,结果纳入记录。
3.灭菌设备宜选用双扉式灭菌柜,并具有自动监测、记录装置功能,其他灭菌器内部工作状态应用仪表检测,其选型、安装、使用应与生产要求相适应,并定期验证。
4.与药液接触的设备、容器具、管路、阀门、输送泵等应采用优质耐腐蚀材质,管路的安装应尽量减少连(焊)接。过滤器材不得吸附药液组份和释放异物。
禁止使用含有石棉的过滤器材。
5、直接接触兽药的包装材料不得回收使用。
6、批次划分原则:
(1)大、小容量注射剂以同一配液罐一次所配制的药液所生产的均质产品为一批。
(2)粉针剂以同一批原料药在同一连续生产周期内生产的均质产品为一批。
(3)冻干粉针剂以同一批药液使用同一台冻干设备在同一生产周期内生产的均质产品为一批。
7、直接接触兽药的包装材料最后一次精洗用水应符合注射用水质量标准。
8、应采取措施以避免物料、容器和设备最终清洗后的二次污染。
9、直接接触兽药的包装材料、设备和其它物品的清洗、平燥、灭菌到使用时间间隔应有规定。
10、药液从配制到灭菌或除菌过滤的时间间隔应有规定。
11、物料、容器、设备或其它物品需进入无菌作业区时应经过消毒或灭菌处理。
12、成品的无菌检查必须按灭菌柜次取样检验。
13、原料、辅料应按品种、规格、批号分别存放,并按批取样检验。
请教原料药的干燥与混合
六类原料药仿制必须用生产线上连续三批产品进行质量研究和稳定性研究后才能申报生产,中试线如与生产线不是同一条线,中试产品是不能直接申报生产的。另外,如果生产线不具备所申报产品生产许可,应先申请该产品生产增项,即扩大生产许可范围。
一般的流程是:
稳定性批次、工艺验证批次(可合并)做完后向省局报产——省局形式审查后接受或发补正通知书——省局受理——研制现场核查、生产现场核查(即动态3批)——3批抽样送省药检所检验——省局完成相关检查报告后通知申请人可封存并寄送资料(资料寄送至CDE)——省药检所完成检验后将检验报告寄送至CDE——CDE在收到申报材料及检验报告后才进入排队序列——等待审评
原料药批产量数量差异原因
这样是可以的,但需要对小批进行验证,验证其最早的湿晶和最后将要进锥的湿晶之间间隔的时间,是否会对产品质量有影响。如果没有影响或是可以忽略不计的。那就可以进行大体积的烘干。不必要进行检测。在原料药中一般分批是在双锥后(双锥后没有混合操作时)故生产厂商多采用此种方法来实现大批次的成品。
制剂稳定性变更原料药也需要三批吗为什么
题主是否想询问“原料药不同批次产量数量差异原因是什么”?原料质量差异、工艺参数变化。
1、原料质量差异:不同批次的原料可能来自不同的供应商或不同的生产过程,因此其质量和纯度可能存在一定的差异。这些差异可能会导致在制药过程中产量的变化。
2、工艺参数变化:制药过程中的工艺参数,如温度、pH值、反应时间等,可能会因为设备调整、操作人员技术水平等因素而有所不同,这些变化可能会对产量产生影响。
新版GMP,注射剂 批量如何制定
需要,法律规定。据律临网得知,《境外已上市境内未上市化学药品药学研究与评价技术要求(试行)》在化学药品注册申请时稳定性要求中规定,加速试验和长期试验应在符合GMP条件下进行,试验样品应为能够代表商业化生产规模的注册批次,建议生产不同批次的制剂采用不少于3批次的原料药。
nmpa对API批次要求
GMP正文第312条(二十七)批 经一个或若干加工过程生产的、具有预期均一质量和特性的一定数量的原辅料、包装材料或成品。为完成某些生产操作步骤,可能有必要将一批产品分成若干亚批,最终合并成为一个均一的批。在连续生产情况下,批必须与生产中具有预期均一特性的确定数量的产品相对应,批量可以是固定数量或固定时间段内生产的产品量。 例如:口服或外用的固体、半固体制剂在成型或分装前使用同一台混合设备一次混合所生产的均质产品为一批;口服或外用的液体制剂以灌装(封)前经最后混合的药液所生产的均质产品为一批。
GMP附录1无菌制剂第六十条 除另有规定外,无菌药品批次划分的原则:
(一)大(小)容量注射剂以同一配液罐最终一次配制的药液所生产的均质产品为一批;同一批产品如用不同的灭菌设备或同一灭菌设备分次灭菌的,应当可以追溯;
(二)粉针剂以一批无菌原料药在同一连续生产周期内生产的均 质产品为一批;
(三)冻干产品以同一批配制的药液使用同一台冻干设备在同一生产周期内生产的均质产品为一批;
(四)眼用制剂、软膏剂、乳剂和混悬剂等以同一配制罐最终一次配制所生产的均质产品为一批。
题主想问的是nmpa对API批次要求是什么吗?对API批次的要求为:
1、原料药。制剂生产商需结合原料药生产工艺,根据现有指导原则和相关文件(含国家局2008年7号文)对原料药的质量进行充分研究与评估,必要时修订有关物质检查方法,增加溶液澄清度与颜色、溶剂残留、细菌内毒素、微生物限度等检查。
2、辅料。辅料应符合注射用要求,制定严格的内控标准。除特殊情况外,应符合现行中国药典要求。
3、直接接触药品的包装材料和容器。注射剂使用的直接接触药品的包装材料和容器应符合国家局颁布的包材标准,或USP、EP、JP的要求。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。