原料药生产技术-原料药生产工艺设计
中文名称:氯雷他定中文别名:百为乐;4-(8-氯-5,6-二氢-11H-苯并[5,6]环庚基[1,2-b]并吡啶-11-烯)-1-哌啶羧酸乙酯;英文名称:Loratadine[1]英文别名:Loratidine; Ethyl 4-(8-chloro-5,6-dihydro-11H-benzo[5,6]cyclohepta[1,2-b]pyridin-11-ylidene)-1-piperidinecarboxylate; 4-(8-Chloro-5,6-dihydro-11H-benzo[5,6]cyclohepta[1,2-b]pyridin-11-ylidene-1-piperidinecarboxylic acid ethyl esterCAS:79794-75-5分子式:C22H23ClN2O2分子量:382.89属于医药方面的
这个并不是你封闭就可以的,关键是你的封闭要有文件支持,也就是验证,验证过你的干燥工段前的工序没有任何的交叉污染。
另外 你所说的GMP的厂房是洁净室还是什么?如果你所说的是洁净室 那就可以明确告诉你 没有必要,如果是无菌要求,经过验证这个进入最终干燥工段前可以达到无菌的要求就可以了。
但是如果你说的不是洁净室,比如指南规定中的要求:
0801 企业的生产环境应整洁;厂区地面、路面及运输等不应对药品生产造成污染;生产、行政、生活和辅助区总体布局应合理,不得互相妨碍。
1. 厂房周边环境情况,生产、行政、生活和辅助区的布局是否合理。
2. 化学合成、脏器组织处理及危险品库、试验动物房等的设置不得对原料药的生产造成污染。
3. 锅炉房的位置煤堆、煤渣的放置,垃圾存放,明沟处理,闲置物资堆放等不得影响原料药生产。
4. 兼有原料药及制剂生产企业,原料药生产不得对制剂生产造成污染或妨碍。
0901 厂房应按生产工艺流程及所要求的空气洁净度级别进行合理布局。
1. 工艺布局:化学合成及其他形式的前处理工序,与精、烘、包工序不得互相妨碍。
2. 厂房空气净化洁净度级别、布局应符合药品GMP中相应条款的规定。
3. 药品法定标准中列有无菌检查项目的原料药,其暴露环境应为10,000级背景下的局部100级;其他原料药的生产暴露环境不低于300,000级。
4. 无菌原料药内包装材料(直接接触药品)的最终处理环境应为10,000级;对于非最终灭菌的无菌原料药,内包装材料最终处理后的暴露环境应为100级或无菌10,000级背景下的局部100级。
这些都是必须的,无论你的生产是什么样子的,这些都是必须的。
你干燥的工段应该不是最后的吧?最后应该是包装啊。所以 把干燥和包装放置于洁净区域 其他工序符合上面的规定就可以了
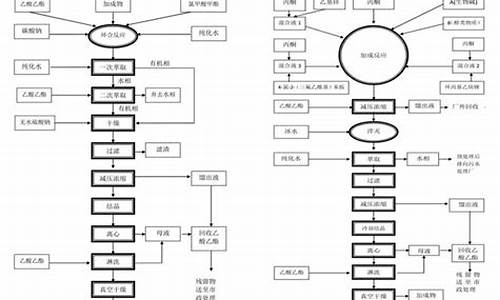
还有一个问题,你的管道符合要求么?按照你的说法,你的管道在最终进入洁净区之前 内容物就已经达到最终成品了,对吧,你的设备已经直接接触产品了,你应该用到卫生级的材质做的管道,还有一个想不通的问题就是,那个你精制是在外面,既然要干燥,说明你干燥前就已经是湿品了,你湿品怎么通过管道输送?传送带?传送带肯定不行,其他的 我想不明白,如果你的产品在液体里进去,那就好说了,那你进去以后还有一个过滤或者离心的过程,这个就可以说是精制了。前面的不过是合成。
看不到工艺,不知道产品,也就只能这么分析下。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。