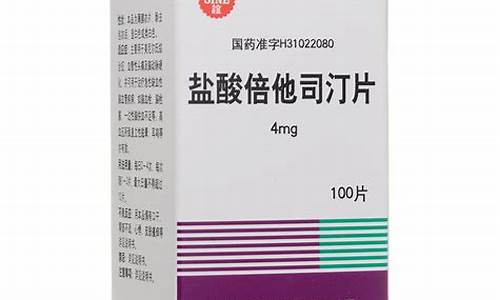
原料药登记状态分类标准-原料药登记状态分类
原料药可以说是医药产业的“芯片”,尤其是近两年在新冠疫情笼罩全球下,对医药产业链压力测试、凸显中国原料药产业在全球的地位举重若轻。经过疫情的洗礼,各国对原料药产业的重视程度明显加大。
为了检索药物合成路线,各处查找期刊、论文、专利资料,头大;
好不容易找到资料,却因埋头苦读、翻译等事项耗费大量时间;
终于搞清楚一篇文献的合成细节,却不清楚有没有其他更好的方法;
原料药数据库使用人群:原料药研发人员、药品信息调研人员、高校师生、医药中间体生产企业、有机化学品销售员。
原料药数据库
1、包含对应的合成路线、反应条件、中间体、试剂信息,并提供对应参考文献,专利溯源。
原料药合成路线
与此同时,还能查看每条合成路线中涉及的中间体和试剂。如果需要更为详细的原始资料,也可根据下方的参考文献,自行查看。
中间体试剂
2、提供全球原料药用量分析、年度各企业用量占比、排行,了解需求企业、市场分布。
用量推算
3、可查询全球60个主要国家原料药进出口的数据,帮助了解原料药进出口趋势、进出口规模,主要市场分布及现状。快速查询目标产品采购商和供应商、数量、金额等详细信息。
查询海关进出口数据
4、可以查询目标产品的全球生产厂商分布,在中国、欧美日韩五个国家地区的登记注册状态;掌握供应企业、竞争企业布局。
注册登记
原料药数据库,集成原料药生产厂商、原料药用量、海关进出口、合成路线、原料药主文件等相关信息一体,实现原料药综合查询的系统。提供全球API供需、市场规模、合成信息一站检索。帮助业内人士快速、高效地完成所需信息的查找与整理。
原料药生产所用原料是否也必须每批留样?其留样时间如何确定?
什么呀。我知道的方法就是在称量瓶中放置这样的药品,当然要看药品的状态在定如何做。干燥失重有很多方法,如果药物的水分不容易出来,可以用一些浸润性的东西增加通透性,当然在一开始的时候要把这些器具包括你要使用的搅拌性的工具都承重,只要是接触到的东西都要称重,然后放入原料药。然后搅拌,然后在好像是半开瓶口的烘干,定时称重,直到两次承重间隔之间的重量误差在规定误差中间,我忘记是多少了,然后就可以计算了。有点乱,一般用作液体的干燥失重。当然要做平行。还有就是药品的程度,在什么温度下和什么时间出去的馏分应该是易挥发物质,而不应该叫干燥失水。如果易挥发组分很容易通透,好像是应该在称量瓶中做。称量使用的器皿在乘凉过程中应该不容易吸湿吧,就是造成质量的变化。好像是乱的。再重新说一遍,就拿称量瓶说吧。
1.实验器具:准备称量瓶,干燥器,纸条,镊子,承托盘
2.步骤:(1)预热烘箱,如果实验是在特定的温度下做
(2)称量瓶在烘箱中干燥特定时间取出,然后在干燥器中放置至室温,承重,重复此过程,直至称量瓶恒重(至少做两个吧有个平行,如果经常使用可以标定号码,知道干燥情况下的这个瓶子是多重就可以了,下次的时候如果可以直接称样,然后进行实验,可以缩短实验过程,但是带样品的干燥失重可能会世间长一些,但总体上是时间减少的,第一次实验的时候总是要预估的。)
(3)称样品。用一个纸条,把称量瓶从干燥器中取出,放置在分析天平上;用镊子把称量瓶的瓶盖打开,倒置在天平上;分析天平归零;放入特定质量的原料药,记录质量;取出称量瓶,半开盖在烘箱中一般一开始是烘干两个小时(半开盖好像是有一个组分的回流过程);取出称量瓶;在干燥器中放置室温;称重(忘记了是不是要打开盖子,觉得好像不用);复烘直至恒重。
3.计算 (称量瓶重+称样重量)/样品重量*100%
两个做平行
平行的计算方式:干燥失重的平均值与单个干燥失重相减的绝对值/干燥失重的平均值
如果这个平行值在误差范围之内,说明我们的实验人为操作误差好像没有太大影响,就是没有做错的操作步骤。等于说这两个值都可取,我们以平均值做为报告结论。如果平行误差超过限定,要重新实验。
4.结论 报告值<7.0%则合格
注意事项:
1.在实验过程中尤其是在干燥之后的称重不得已手接触器皿,因为手上会有汗水之类的东西影响称重重量;最好是整个过程都不用手接触,可以用纸条,镊子之类的东西;或许会用到承托盘,可以称量瓶的运输过程。
2.平行实验的平行数量看自己的误差吧。自己控制。
3.称样品中称样高度不得太高,尤其是液体的吧,可能会容易造成压力使得馏分在底部不容易上升。
4.计算过程的数据取小数点后两位,结论叫四舍五入呀,你看看吧,反正不一定是5的时候就是入的,有很多种进位方式。有的时候5以后为0的时候要看0以后的是奇数还是偶数,但是我忘记了是怎么进位得了。
只写到这吧,我也忘记了,也不定是对的。干燥时间和干燥物品的性质有关,不一定是3小时,干燥的温度也不一定是105摄氏度,因为不知道被干燥物质在什么温度下容易发生反应。反正我们要找到一个我们所要求的最终结果的最好的试验方法才可以。就像是液相的物质检测的波长,在不同的波长下所激发的吸光度值的感应量是不同的。总要找到一个合适的值来进行检测,不一定在最大吸收波长,只要是能够和对照品对照就可以了,因为我们还要照顾到别的被检物质的吸收光波长。如果可以多通路的可能更好一些。反正自己看仪器。
原料药数据分析系统怎么样?
例如,片剂在压片后进行内包装,压片结束后检测鉴别、含量均匀度等理化项目,而内包装之后仅取样检测微生物限度,最后成品放行的检验报告数据采用压片之后的理化项目数据和内包装之后的微生物限度数据,这样做是否可行? 答:放行,系指对一批物料或产品进行质量评价,作出批准使用或投放市场或其他决定的操作。一般情况下,如果企业对成品进行质量评价,能够确认中间产品的关键质量属性到成品时未发生变化,中间产品的检验结果能够代表成品放行前的检验结果,则可以引用中间产品的检验数据和结果。 企业如果采用这种方式,则必须对中间产品的关键质量属性到成品状态时的变化情形进行科学研究或评价,确保中间产品的检验数据能够代表最终包装完成的成品。应当注意,并非所有中间体的关键质量属性到最终放行时都不会产生变化。 2.问: 答:《药品生产质量管理规范(2010年修订)》明确要求制剂生产用每批原辅料和与药品直接接触的包装材料均应当有留样,并对留样作出了详细要求,而对于原料药则没有详细规定,但在第十二条(七)中明确规定:物料和最终包装的成品应当有足够的留样,以备必要的检查或检验。 原辅料留样的目的是为了能够有追溯性,一旦上市或未上市产品出现问题,企业能够从物料角度查找分析可能产生的原因。因此,企业还是应当根据其对成品质量影响的情形进行分析,从而决定是否留样、如何留样并形成操作规程。一般而言,原料药生产所用的起始物料、对原料药质量有直接或关键影响的那些关键物料均应当留样。 3.问:我们生产最终灭菌的大容量注射剂,从配制到灭菌的时限,工艺规程描述为不超过12小时,但实际工作中最多也超不过8小时,那么,12小时的时限是否必须要通过验证?8小时的时限也是否必须要通过验证? 答:《药品生产质量管理规范(2010年修订)》第五十七条规定:应当尽可能缩短药液从开始配制到灭菌(或除菌过滤)的间隔时间。应当根据产品的特性及贮存条件建立相应的间隔时间控制标准。 灭菌工艺的有效性不仅与灭菌参数有关,还与待灭菌物品的微生物负荷量有关。建立间隔时间控制标准的目的是为了控制待灭菌产品的微生物负荷量,使灭菌工艺能够达到相应的效果。 药液的微生物负荷量会随着时间的延长而增加。企业根据灭菌工艺能力确定可接受的最大微生物负荷量之后,应根据产品特性和贮存条件考察、建立并控制药液从配制至灭菌的时间,以控制微生物负荷量在可接受的最大范围之内。 问题中工艺规程规定的时限应当是经过验证的。如果最长的12小时时限已经过验证,根据实际工作情况,在其他条件不变的情形下,将时限缩短至8小时可不再验证。 4.问:检验人员须经过与所从事的检验操作相关的实践培训且通过考核。是不是药企的QC只要经过公司内部的岗位培训并考核合格就能上岗,不再需要经过药检或药品监管部门认可的机构培训后发证上岗? 答:《药品生产质量管理规范(2010年修订)》对检验人员提出了要求:质量控制实验室的检验人员至少应当具有相关专业中专或高中以上学历,并经过与所从事的检验操作相关的实践培训且通过考核。 该规范没有强制规定企业的检验人员需经过药检或药监部门认可的机构培训后发证上岗,其注重的是培训的有效性,企业应确保培训后检验人员检验的准确性。企业可采取理论培训、实践培训、或者师傅带徒弟等多种方式,也可以采取委托第三方机构进行培训的方式对检验人员进行培训,但必须注意,培训和考核仅仅是确保检验结果准确性的手段。
原料药对于医药产业链是上游的存在的属性,是保障药品供应、满足人民用药需求的基础,目前各国对于原料药产业的重视程度明显加大。
但是在原料药研发和使用的过程中,很多人都是“开头难、结尾也难”,为了检索药物合成路线,需要查询大量的刊期、论文、专利资料等等,耗时耗力,找到资料搞清一篇文献的合成细节,却找寻不到更多更优质的合成路线;想要购买却找寻不到合适的厂商,想要分析原料药进出口数据,分析市场动态,却没有数据来源。
对此,药融云重磅推出了原料药数据库,集成原料药生产厂商、原料药用量、海关进出口、合成路线,原料药注册信息、登记信息等,实现原料药综合查询的系统,提供全球API供需、市场规模、合成信息一站检索,帮助业内人士快速、高效的完成所需信息的查找与整理。
原料药行业数据分析系统适用于:原料药研发人员、调研人员、高校师生、医药中间体生产企业、有机化学销售员等。
一、查询合成路线,筛选最佳方案
任何一个化合物的合成路线通常都有多条,药物合成也是这样,原料药的合成,最终的目的是要走进工厂批量化的生产,选择一条适合自己生产情况的路线是至关重要。
原料药系统
药融云数据库整合了多条合成方法,包含对应的合成路线、反应条件、中间体、试剂信息。并提供了对应的参考文献,专利溯源。
1、查询合成路线
列如:在合成路线数据库中通过名称搜索“Ezetimibe”合成路线共一百多条。
药物合成路线
2、查询中间体和试剂
除了查询合成路线还可查看每条合成路线中涉及的中间体和试剂,还提供更为详细的原始资料,也可根据下方的参考文献,自行查看。
中间体试剂
二、调研市场需求、为立项/市场分析做参考
1、原料药用量推算
根据每年全球市场制剂用量推算,收载得到6000+原料药用量信息。不同品种、不同企业、不同国家市场下,各个年份中该原料药的详细用量、占比及排行;并包含全局分析模块,清晰展示各品种、区域中该产品的用量对比情况,便于探究某原料药在目标市场近年的大致用量,及分析潜在的客户、竞争企业。
调研市场需求,为立项/市场分做参考
2、查询海关进出口信息
包含了中国、美国、俄罗斯、印度等各国海关进出口货物的货物名称、时间、进口商、出口商、数量及价格等信息,可通过货物名称、海关编码、提单号检索,并支持进出口国家筛选,帮助您方便快捷地了解药物的进出口情况,进行全面市场调研、分析市场动态。
原料药海关进出口
三、生产厂商分布一键查,掌握企业供应竞争布局
在药融云原料药数据库中,可以查询目标产品的全球生产厂商分布,在中国、欧美日韩等五个国家地区的登记注册状态;掌握供应企业、竞争企业布局。
如检索「Ritonavir」,可看到该原料药在全球范围内有近50家企业可生产。中国、印度、意大利、美国等10个国家均有相应的生产企业,其中印度最多,有21家企业可生产;其次为中国,中国安徽、上海、石家庄等省市有十余家企业可生产。
掌握企业供应竞争布局
四、查询注册登记信息,满足更多需求
包含CDE原料药、药用辅料和药材包登记信息、美国DMF注册、欧盟CEP认证、日本MF注册、韩国DMF注册、FDA批准辅料等。
注册登记信息、分析更多需求
药融云原料药行业数据分析系统助力于,原料药市场分析、用量推算,查询合成路线、中间体、试剂等等,助力于业内人士快速查询相关数据。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。