原料药注册申报流程及时间要求-原料药注册申报资料
药品检验作为保证药品安全有效和质量可控的技术支撑,处于技术监督的支柱地位。通过注册检验、监督检验,承担着为药品技术审评、行政规制、行政处罚等提供科学、公正的检验数据的职责。近期已有不少申请人收到不同产品、不同申报阶段的药品注册检验通知书或补充资料。2020年7月1日《药品注册管理办法》相配套的《药品注册检验工作程序和技术要求规范(试行)》(2020年版)(以下简称“新规范”)的出台,进一步规范药品注册检验工作程序,明确注册检验技术基本要求。
较之旧版的注册检验管理办法,新规范在工作程序方面,将前置注册检验要求融入现行注册检验工作程序中,并通过规范和优化有关环节,加强药品检验机构、药品审评中心和注册检验申请人三者之间信息沟通,提升药品注册检验质量和效率;在技术要求方面,总结提炼出适用于中药、化学药、生物制品、按药品管理的体外诊断试剂和药用辅料和药品包装材料基本要求,包括:资料审核、样品检验和标准复核。
该《规范》自2020年7月1日起实施。接下来本文将对药品注册检验的适用范围、检验分类、检验流程、提交资料、样品要求、相关时限等角度做一个系统的总结。
注册检验的流程要点简析
一、药品注册检验适用范围
1、样品检验;
2、标准复核。药品标准复核工作实际上可以理解为:指定药品检验机构为国家药品监督管理局核准药品质量标准(药品注册标准)提供实验室依据。
与国家药品标准收载的同品种药品使用的检验项目和检验方法一致的,可以不进行标准复核,只进行样品检验。其他情形应当进行标准复核和样品检验。
二、药品注册检验分类
根据药品注册检验启动主体和药品注册阶段不同,将药品注册检验分为如下四部分:
图1 药品注册检验分类
其中,上市申请审评中的注册检验,根据类型内容的不同,又可以分为,质量标准部分项目复核、现场核查抽样检验、有因抽样检验。
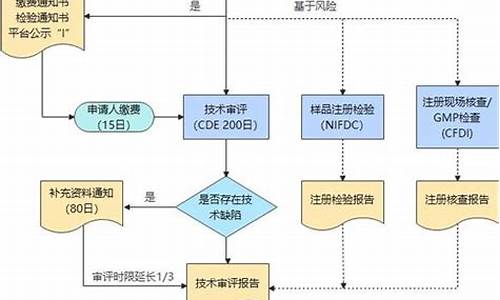
三、药品注册检验流程
(一)境内药品注册检验
图2 境内药品注册检验流程图
其中1准备申请模块为新增模块,体现了此次注册检验升级“优化注册检验工作程序”的理念:给申请人与药品检验沟通开辟途径,提前解决后续注册检验过程中可能遇到的问题,提高注册检验质量和效率。申请人送检环节拆分为先进行资料审核,通过后进行样品检查,方便申请人通过信息化方式报送资料,实现让申请人少跑路,提高送检效率和满意度。
另外,新规范也进一步规范了注册检验工作程序:规范注册检验过程中发补处理,要求药品检验机构一次性提出发补要求,申请人按时限一次性补充到位。对于因特殊情况未按时限补充到位的,给予申请人重新约定补正时间的机会。对于在新的约定时限仍未能补充的,在资料和样品接收阶段,视同撤回申请;在注册检验过程中,因故出具部分结果报告的,应在复核意见中说明情况。明确注册检验流程出现的异常情形处理,如优先检验、流程暂停和重启、撤检和退检的情形。
不同类型的注册检验流程概括如下:
(1)前置注册检验申请:申请人向申请人或生产企业所在地省级药品监督管理部门提出抽取样品申请。省局在收到申请后的5个工作日内按规定要求组织抽取3批样品并封签,同时出具抽样记录凭证。
(2)上市申请受理时注册检验申请:申请人凭药品审评中心出具的注册检验通知书,在30个工作日内,向省级药品监督管理部门申请完成抽样工作,向中检院或相关省级药品检验机构提出注册检验申请。
(3)上市申请审评过程中注册检验申请:申请人凭药品审评中心出具的药品注册检验通知和补充资料通知,向相应药品检验机构提出药品注册检验申请。
有因抽样检验:药品审评中心直接向相应药品检验机构出具药品注册检验通知,提出注册检验要求,提供检验所需相关材料。检验所需样品由药品审评中心组织国家药品核_中心或省级药品监督管理部门抽取并封签,并在规定条件下送至相应药品检验机构。样品批次和每批数量由药品审评中心与药品检验机构商定。
(4)上市批准后变更注册检验申请:申请人凭药品审评中心出具的药品注册检验通知向相应药品检验机构提出注册检验申请。
(二)境外药品注册检验
境外药品注册检验:统一由中国食品药品检定研究院受理,药检院完成注册检验工作。此次升级,本部分的送样流程也进行了优化调整:统一通过在线提交进口注册检验申请;调整申请人送样方式,通过进口注册检验申请审核的由申请人分别同时向承担任务的口岸药检机构和中检院送样,提高送样效率。
四、申请药品注册检验应提交的资料
以上资料需在样品送检前或送检时提供相应纸质版(加盖公章),纸质版和电子版(光盘或U盘)资料必须保持一致,且应当与注册申报资料的相应内容一致,确保资料真实、充分、可靠,境外生产药品应同时提供中、英文版的资料。
五、申请药品注册检验对样品的要求
图3 药品注册检验对样品的要求
六、相关时限
大的流程上,串联改并联。注册检验原则上应在规定的审评时限结束前完成报告。
图4 2020版与2007版注册检验时间安排对比
图5 注册检验中对于送样时限、检验时限以及不计时限情形的要求
因品种特殊及检验工作中的特殊情况,药品检验机构需要延长检验时限的,经相关负责人批准后,告知申请人和药品审评中心,对于前置注册检验,仅告知申请人。延长时限不得超过原时限的1/2。
七、对送检人的要求
送检人须经申请人(或境内代理人)授权,详知送检相关要求及所送资料和样品等信息,在申请时认真核对申请表、委托单等相关信息后签字确认,注意保存注册检验送检过程中出具的相关凭证,配合办理药品注册检验送检有关事项。
八、检品编号及作用
检品编号是药检院受理检验申请后赋予样品的唯一性标识。《药品注册检验接收通知书》中将注明检品编号,申请人可凭此编号查询检验进度。
九、补充资料通知
检验中需要申请人补充注册检验相关的资料、标准物质和特殊试验材料等的,检验部门会与申请人沟通后一次性提出,并出具《药品注册检验补充资料通知书》,告知需要补充的内容及时限,要求申请人一次性补充完成。逾期未完成且未提前向药检院申请调整补充时限的且获得同意的,药检院在继续完成其它检验项目后,出具部分项目的检验报告,并将无法完成原因写入标准复核意见。
上述内容从补充资料的角度,规范注册检验工作程序,也是此次新规范的升级后的新要求。
十、申请人获取检验报告的途径
药检院业务部门按药品注册检验申请表填写的联系地址邮寄至申请人(境外生产药品寄至其境内代理人),或由申请人派人凭身份证和单位介绍信或《药品注册检验接收通知书》到药检院业务受理大厅领取。
结合常见补正问题以及新规范体现出来的一些升级,对如下内容再强调一下:
(1)药品注册检验申请人应与药品上市许可申请人保持一致(谁申请注册检验,谁作为上市许可申请人)
(2)申报注册检验的药品质量标准应当符合药品审评中心发布的药品质量标准通用格式及撰写指南要求。
(3)申报品种的注册检测项目或指标不适用《中国药典》的,申请人应当提供充分的支持性数据。
(4)药品检验机构与药品审评中心通过“数据共享平台”进行信息沟通,包括注册检验用样品和资料接收审核情况、注册检验暂停和重启、时限延长、终止注册检验的信息以及注册检验报告的推送。
(5)药品注册检验所需样品应当为商业规模生产3个批次(特殊情况下,治疗罕见病的药品除外),每批样品数量为质量标准全项检验所需量的3倍。
(6)样品剩余有效期时间应不少于2个药品注册检验周期,如同时进行样品检验和标准复核的,为180个工作日;如进行样品检验的,为120个工作日。
(7)药品审评中心启动的注册检验,申请人应当在30个工作目内,向省级药品监督管理部门申请完成抽样并向药品检验机构送样。现场核_抽样检验应在抽样后10个工作日内向药品检验机构送样。
从上面的6、7两条,我们应充分重视“前置检验”的必要性。不前置检验的话,稍微出点岔子,就会来不及送检。
如果注册申请本来不需要注册生产现场检_(就算有,也只有一批),仅仅为了注册检验重新生产三批新鲜样品的话,非常不值当。如果碰到审评中要求进行注册检验(哪怕只是单项复核),还有注册检验资料发补,那就更有可能出现样品的有效期赶不上注册检验剩余有效期要求的情况了。
(8)因化学药制剂注册检验需要对化学原料药进行检验的,应当由申请人一并提供化学原料药样品和相关资料。仿制境内已上市药品所用的化学原料药,可以单独申请药品注册检验。
(9)申请人须同时提供注册检验用资料和样品标签的纸质版(加盖申请人公章)和相应的电子版。境外生产药品的注册检验,申请人应提供前述资料和样品标签的中、英文版。(注意学习,送检物资的准备要求)
(10)检验资料中包括:药品通用技术文件(CTD)资料:模块2(概要)中2.3(质量总体概述):模块3(药学研究资料)。原料药随制剂同时申请上市许可的,应按要求同时提供原料药和制剂的资料。也就是说,如果前置检验的话,光做完工艺验证还是不够的,得把药学资料写完了才行。
药品注册上市申报时提交完善的药品生产工艺资料至少是
请我跟您们做顾问嘛!呵呵。一般是先交省局,然后再经省局提交给农业部。原料药GMP申报资料一般交省局2份(自己留4份,开首次末次会议用)。
第四条 新建(含已获得兽药生产许可证的企业拟新增产品剂型的)或改扩建的兽药GMP企业,应当提出兽药GMP检查验收申请。
第五条 申请兽药GMP检查验收的企业应当填报《兽药GMP检查验收申请表》(见附录1),并按以下要求向兽药GMP办公室报送书面及电子文档的申报资料各一份(其中电子文档应填齐生产和检验管理文件的全部内容):
(一)新建企业
1.企业概况;
2.拟生产兽药类别、剂型及产品目录;
3.企业组织机构图(须注明各部门名称、负责人、职能及相互关系);
4.企业负责人、部门负责人简历;专业技术人员及生产、检验、仓储等工作人员登记表(包括文化程度、学历、职称等),并标明所在部门及岗位;高、中、初级技术人员占全体员工的比例情况表;
5.企业周边环境图;总平面布置图;仓储平面布置图;质量检验场所平面布置图及仪器设备布置图;
6.生产车间概况及工艺布局平面图(包括更衣室、盥洗间、人流和物流通道、气闸等,人流、物流流向及空气洁净度级别);空气净化系统的送风、回风、排风平面布置图;工艺设备平面布置图;
7.拟生产兽药产品的工艺流程图、主要过程控制点和控制项目及产品的生产、质量管理文件目录;
8.生产的关键工序、主要设备、制水系统、空气净化系统、检验仪器设备及产品工艺验证报告;
9.检验用仪器仪表、量具、衡器校验情况报告;
10.农业部认可实验室出具的洁净室检测报告书;
11.其他兽药GMP管理文件目录及与文件相对应的记录、凭证样张;
12.生产设备设施、检验仪器设备目录(需注明规格、型号、主要技术参数);
13.兽药GMP运行情况报告;
14. 试产兽药国家标准产品的批生产、批检验记录复印件(每条生产线应选择具有剂型代表性的2--4个品种,每个品种至少3个批次的记录;少于2个品种或者属于特殊产品及原料药品的,应提供所生产品种的记录)。
(二)改扩建企业
除提供上述1至13项资料外,还须提供以下资料:
1.《兽药生产许可证》和《企业法人营业执照》复印件;
2.企业自查情况(包括企业概况、GMP实施情况等);
3.已获批准生产的产品目录和产品生产、质量管理文件目录及产品标准执行情况、产品批准文件(包括产品批准文号批件、质量标准的复印件等);
4.兽药GMP运行情况报告及批生产、批检验记录复印件(同上款“(一)14.”要求)。
第六条 兽药GMP办公室在收到申报资料之日起20个工作日内完成资料的审查工作。通过审查的,组织现场检查验收工作。审查不合格的,书面通知申请企业在4个月内补充有关资料,逾期未报送的按撤回申请处理。
用于药品注册审批的是
三点要求。
1、药品处方、生产工艺、药品标准是指该品种现行的处方、工艺及质量标准。如与取得药品批准证明文件时相比有变化的,须按批准时间列出历次变更项目及内容,并提供补充申请批件。药品处方包括活性成分或中药药味、辅料的种类和数量。现行生产工艺包括完整的生产流程、每个单元操作、单元操作的主要工艺控制参数及主要质量控制参数等。药品标准需提交复印件,现行版本药典标准可不提供。
2、同时提交药品处方、生产工艺与国家药品监督管理局审批一致的真实性承诺书,承诺书必须有法人代表亲笔签名并加盖公章。
3、应当提供经核准的生产药品制剂所用化学原料药、中药材和中药饮片、中药提取物、制剂中间体等的来源,其中按照药品管理的,应提供药品批准证明文件。变更或增加原料药来源的,应当提供批准证明文件或备案情况公示内容。
土耳其原料药出口注册流程
国产药品审批主要是通过上报后经过省级药品监管部门、药品注册司、药品审评中心等重重审评后,经药品注册司确认后完成注册审批。注册审批流程如下:一是审请者填写并提交新药申请表及申报资料;二是省级药品监督管理部门初审和原始资料审核及现场考察,同时省级药品检验所复核检验;三是药品注册司形式审查;四是药品审评中心技术审评,同时药品审评委员会技术审评;五是药品注册司审核和发给新药补充申请批件,同时发给试生产转;六是局领导批准,药品注册司发给新药临床研究批件和发给新药证书和生产批件。
法律依据:《中华人民共和国药品管理法》 第二十五条 对申请注册的药品,药品监督管理部门应当组织药学、医学和其他技术人员进行审评,对药品的安全性、有效性和质量可控性以及申请人的质量管理、风险防控和责任赔偿等能力进行审查;符合条件的,颁发药品注册证书。药品监督管理部门在审批药品时,对化学原料药一并审评审批,对相关辅料、直接接触药品的包装材料和容器一并审评,对药品的质量标准、生产工艺、标签和说明书一并核准。本法所称辅料,是指生产药品和调配处方时所用的赋形剂和附加剂。
原料药注册与新药注册有区别吗?
土耳其原料药出口注册流程
原料药是我国医药产业参与国际竞争的优势长板,新冠疫情发生以来,全球医药产业链受到冲击,使得我国原料药产业的战略地位进一步提升。据国家发改委统计,我国几乎可以生产全部品种的原料药,种类高达1500多种,其中60%产量用于出口。截止到2019年,我国原料药共出口到189个国家和地区,主要集中于亚洲、欧洲和北美洲三大市场,国际认证是出口必不可少的一道手续。原料药出口需要递交大量的产品相关资料给当地政府或相关机构获得认证后才能出口,如果不是相同语言的国家出口原料药,所递交的资料和各类说明文件还要进行翻译。原料药认证所需的相关资料对格式要求非常严格,并且专业术语多、难度大。
原料药认证翻译拥有以下资质能更快更好地获得认证:
翻译人员是药学或医学相关专业
熟悉各国的认证流程和相关政策
熟悉认证资料格式和相关术语
国际上常见的三种原料药认证分别为美国的FDA认证、欧洲EDQM认证和日本PMDA认证
FDA认证
美国FDA认证分为五类:I型-生产地点和厂房设施、II型-中间体、原料药和药品、III-型包装物料、IV-型辅料、着色剂、香料、香精及其他添加剂、V-型非临床数据资料和临床数据资料
一般情况下中国厂商的申报认证程序如下:
显示所有大图
EDQA认证
欧洲的CEP 只适用于已有《欧洲药典》( EP) 标准的原料,即 EP 收载的原料药品种。
申请CEP的基本程序包括:
PMDA认证
日本的PMDA认证只能通过日本国内的管理人将MF申请递交给PMDA官方,不能由自己直接递交。
申请MF的基本程序包括:
无论是哪一个国家的申请都离不开CTD文件、GMP检验报告、官方提出的修改意见及问题和补充文件及回复说明。各国文化背景的不同使语言成为了横亘在中间最急需攻克的难题。
国家
修改意见及问题
补充文件及回复说明
美国
483表问题
现场检查及483表的回复说明
欧洲
EDQM提出的修改意见
GMP检查的回复补充说明
日本
PMDA提出的缺陷问题
对PMDA提出的缺陷进行回复
CTD的排版要求
CTD中信息的表达要明确、清楚,申请人不应修改CTD的整体结构,以利于审查内容和快速查找。
纸张大小:欧洲和日本-A4,美国letter纸(8.5X11``)文档和表格应留出余地,以方便在纸张上打印。左手边空白部分应保证装订不受影响
字体:文档和表格的字符大小应足以清楚阅读,建议描述性文档采用Time New Roman,12的字符。
缩写词应在每模块中第一次使用时进行定义。
每页必须有编号页码。
美国DMF文件M1要求
CUVER LETTER(首页)
STATAMENT OF COMMITMENT(声明信)
Administrative Page(行政信息)
US Aent Appointment Letter(美国代理人的指定)
Letter of Authorization(授权信)
Holder Name Transfer Letter(证书持有人转移)
New Holder Acceptance Leeter(新持有人接受函)
REQUEST TO(WITHDRAW,CLOSE) a DMF(DMF的取消与关闭)
Paten satement(专利声明)
欧洲CEP申请文件M1要求
申请表
letter ofAuthorisation(授权信)
declaration in cases where the manufacturer is not the intended holder of a Certificate of Suitability(证书持有人与生产厂商不同的声明信)
letter of declaration of willingness to be inspected(愿意接受检查声明)
letter of declaration of substances of animal/human origin(TSE风险的声明)
letter of commitment to provide samples upon requert by the EDQM(愿意提供样品的声明
模块M2:质量综述
项目
2.3.S.1基本信息
2.3.S.1.1药品名称
2.3.S.1.2结构
2.3.S.1.3理化物质
2.3.S.2生产信息
2.3.S.2.1生产商
2.3.S.2.2生产工艺和过程制作
2.3.S.2.3物料控制
2.3.S.2.4关键步骤和中间体控制
2.3.S.2.5工艺验证和评价
2.3.S.2.6生产工艺的开发
2.3.S.3结构确证
2.3.S.3.1结构和理化性质
2.3.S.3.2杂质
2.3.S.4原料药的控制
2.3.S.4.1质量标准
2.3.S.4.2分析方法
2.3.S.4.3分析方法的验证
2.3.S.4.4批检验报告
2.3.S.4.5质量标准制定依据
2.3.S.5对照品
2.3.S.6包装材料和容器
2.3.S.7稳定性
2.3.S.7.1稳定性总结
2.3.S.7.2上市稳定性承诺和稳定性方案
2.3.S.7.3稳定性数据总结
模块M3: 质量部分
项目
3.1目录
3.2.S原料药
3.2.S.1一般信息
3.2.S.1.1命名
3.2.S.1.2化学结构
3.2.S.1.3一般特性
3.2.S.2生产
3.2.S.2.1生产商
3.2.S.2.2生产工艺和过程控制的描述
3.2.S.2.3物料控制
3.2.S.2.4关键工艺步骤和中间体的控制
3.2.S.2.5工艺验证
3.2.S.2.6生产工艺的改进与变更控制
3.2.S.3结构表征
3.2.S.3.1结构表征和其他特性
3.2.S.3.2杂质
3.2.S.4原料药控制
3.2.S.4.1质量标准
3.2.S.4.2分析方法
3.2.S.4.3分析方法验证
3.2.S.4.4批分析报告
3.2.S.4.5质量标准合理性分析
3.2.S.5对照品
3.2.S.6包装容器和密封方式
3.2.S.7稳定性实验
3.2.S.7.1稳定性实验概述和结论
3.2.S.7.2申请批准后的稳定性实验方案和稳定性保证
3.2.S.7.3稳定性实验结果列表
雅瑞思医学翻译一直专注于医药、医疗器械领域翻译,拥有上百名药学、医学、物理学、生物学、制造学、工程学专职翻译专家。医药翻译部由药理学、毒理学、生药学、药物化学、药物分析学、药剂学、临床医学、临床药理学背景的专业翻译人员组成,都曾在药厂或者大学药学院工作、学习过,对原料药DMF、IND、AND的全套文件翻译极为熟悉,多数成员都具备医学或者药学硕士及以上文凭。
你仔细研究一下《药品注册管理办法28号令》
如果是新药,没有原料药批文的话,那你是原料和制剂要一起申报的了。
如果已经有制剂了,那你的原料药注册大概要按新药注册流程来做,但不算新药了吧
仅供参看。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。












