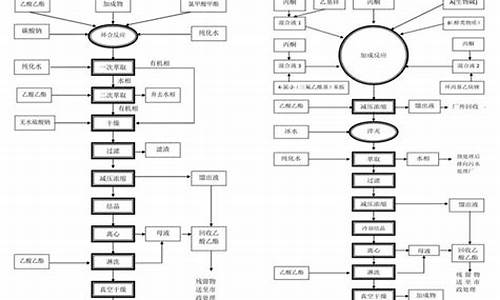
头孢呋辛钠原料药合成-头孢呋辛钠原料药

化学药是通过人工的工艺路线设计,在反应釜中加入基础化合物(如甲烷、乙烷、甲苯、醋酸、甲醇、乙醇等等)基础原料进行化学反应合成出来的药物;
而生物药则指的是培养微生物菌种,并将菌种扩大化,在适宜的温度、压力、氧气等条件下,加入营养液,促使微生物菌群发酵产生的代谢物,这一类具有治疗作用的化学物质就叫生物药。
扩展资料
药品
根据《中华人民共和国药品管理法》第一百零二条关于药品的定义:药品是指用于预防、治疗、诊断人的疾病,有目的地调节人的生理机能并规定有适应症或者功能主治、用法和用量的物质,包括中药材、中药饮片、中成药、化学原料药及其制剂、抗生素、生化药品、放射品、血清、疫苗、血液制品和诊断药品等。
2013年1月,国家发展和改革委员会发出通知,决定从2013年2月1日起调整呼吸、解热镇痛和专科特殊用药等药品的最高零售限价,共涉及20类药品,400多个品种、700多个代表剂型规格,平均降价幅度为15%,其中高价药品平均降幅达到20%。
特性介绍
从使用对象上说:它是以人为使用对象,预防、治疗、诊断人的疾病。有目的地调节人的生理机能,有规定的适用症、用法和用量要求;从使用方法上说:除外观,患者无法辨认其内在质量,许多药品需要在医生的指导下使用,而不由患者选择决定。同时,药品的使用方法、数量、时间等多种因素在很大程度上决定其使用效果,误用不仅不能“治病”,还可能“致病”,甚至危及生命安全。因此,药品是一种特殊的商品。
1、种类复杂性:具体品种,全世界大约有20000余种,我国中药制剂约5000多种,西药制剂约4000多种,由此可见,药品的种类复杂、品种繁多。
2、药品的医用专属性:药品不是一种独立的商品,它与医学紧密结合,相辅相成。患者只有通过医生的检查诊断,并在医生与执业药师的指导下合理用药,才能达到防止疾病、保护健康的目的。
3、药品质量的严格性:药品直接关系到人们的身体健康甚至生命存亡,因此,其质量不得有半点马虎。我们必须确保药品的安全、有效、均一、稳定。
另外,药品的质量还有显著的特点:它不像其他商品一样,有质量等级之分:优等品、一等品、二等品、合格品等等,都可以销售,而药品只有符合规定与不符合规定之分,只有符合规定的产品才能允许销售,否则不得销售。
管理规范
药品质量符合规定不仅是产品质量符合注册质量标准,还应使其全过程符合《药品生产质量管理规范》(简称GMP)。
《药品生产质量管理规范》(Good Manufacture Practice,GMP)是药品生产和质量管理的基本准则,适用于药品制剂生产的全过程和原料药生产中影响成品质量的关键工序。大力推行药品GMP,是为了最大限度地避免药品生产过程中的污染和交叉污染,降低各种差错的发生,是提高药品质量的重要措施。
参考资料来源:百度百科-药品
药品储存条件要求常温区阴凉区的温度要求
乌拉地尔停产是由于公司破产造成的。2020年,河北柏奇药业有限公司由于无力偿还债务、发放薪资、恢复生产等原因,该企业最终向当地法院申请了破产并冻结股权,河北柏奇药业有限公司是石家庄一家原料药生产销售的制药企业,主营业务有无菌原料药(头孢呋辛钠、头孢西丁钠、头孢尼西钠、头孢唑肟钠等)、原料药(盐酸丙哌维林、更昔洛韦、盐酸氟桂利嗪、吗替麦考酚酯、盐酸乌拉地尔、头孢克洛、头孢呋辛酯、头孢克肟等)等产品的生产,由于金链断裂、经营不善,最终破产,导致旗下所生产的药品也相应停产。
化学制剂行业综合分析
常温区需在0-30℃内,阴凉库需在20℃以下。
应按药品的温、湿度要求将其存放于相应的库中,药品经营企业各类药品储存库均应保持恒温。对每种药品,应根据药品标示的贮藏条件要求,分别储存于冷库(2-10℃)、阴凉库(20℃以下)或常温库(0-30℃)内,各库房的相对湿度均应保持在45%—75%之间。
所设的冷库、阴凉库及常温库所要求的温度范围,应以保证药品质量、符合药品规定的储存条件为原则,进行科学合理的设定,即所经营药品标明应存放于何种温湿度下,就应当设置相应温湿度范围的库房。如经营标识为15-25℃储存的药品,就应当设置15-25℃恒温库。
对于标识有两种以上不同温湿度储存条件的药品,一般应存放于相对低温的库中,如某一药品标识的储存条件为:20℃以下有效期3年,20-30℃有效期1年,应将该药品存放于阴凉库中。
扩展资料中药材、中药饮片储存:应根据中药材、中药饮片的性质设置相应的储存仓库,合理控制温湿度条件。对于易虫蛀、霉变、泛油、变色的品种,应设置密封、干燥、凉爽、洁净的库房;对于经营量较小且易变色、挥发及融化的品种,应配备避光、避热的储存设备,如冰箱、冷柜。
对于毒麻中药应做到专人、专帐、专库(或柜)、双锁保管。
针对不同的仓储条件,结合《药品经营质量管理规范》的各项要求,在日常工作当中,加大对药品储存及养护保管的重视,加强工作责任心,熟悉各种药品理化特性,采取科学、合理的方法进行药品的储存,是保证药品质量可控的必要措施,也是药品发挥治病救人本质属性所必需的前提条件。
参考资料:
联邦制药的产品简介
? 这周的化学制剂行业公司很多,有52家呢,第一项我们先来看看行业的总资产周转率,发现除了个别几家的数据大于 1 以外,多数公司的数值都是小于1 的,可以判断该行业也是烧钱的行业,需要不断的投入资金才能不断发展的~
第二项,我们通过公司的股东报酬率,现金占总资产比率,净利率,这三项指标来进行筛选~~~
按照这三项指标同时达到的标准来筛选,我们得到了以下 13? 家公司:
按照上市时间,又筛掉了五家公司,最后剩下了六家公司做为初选:恒瑞医药,山大华特,恩华药业,信立泰,海思科,华润双鹤,还有两家公司 灵康药业,康弘药业,虽然是2015年上市的,但数据符合,先保留!所以一共是八家公司备选~~
整体观察了下这八家公司的市值及销售规模,去掉了 山大华特,海思科,灵康药业这三家公司,康弘药业的流通A股有些少,但市值很高,销售额也可以,所以特意去查了下该公司的股本情况,发现2018年时公司股票有很大一部分都己经上市流通了,所以也把康弘药业纳入继续观察范围之内~~
下面用五大数字力,来分析一下四家公司的情况:
一,现金能力板块
从整体数据来,化学制剂行业明显比包装及传媒行业有钱多了呢,其中恒瑞医药的数据很是亮眼,所有指标全都达标,明显是现金奶牛的架势啊,但发现现金占比从2017年的34%下滑到2016年的23%,比例很大啊,所以去看了下财报,发现是购买理财产品导致的,货币资金 42.67亿加上其他流动资产的 46.44亿,资产总计180亿,妥妥的现金占比49.5%,现金储备足够大啊,唯一美中不足的就是平均收现天数,行业平均数值是85.1天,恒瑞医药的平均天为118天,但做为体量这么大的一家公司,我们看到的是五年趋势一直是在往低了走的,证明公司的还是很重视这一块的,一直在努力
同样的数据,我们来观察 信立泰,也发现的同样的问题,2017年的现金占比直接从26.2% 滑到12.1%,然后在其年报及资产负债表中都发现了是由于购买了理财产品,导致了其他流动资产的增加,其货币资金8.29亿 + 其他流动资金9.13亿,在总资产的占比仍有25%之多~~
信立泰 的平均收现天数 是138天,也远大于行业平均值85天,但也可以看到其近五年的数值一直是在往低了走了,趋势在向好的方向发展的,包括现金模块的整体数据大部份都达标了,所以,仍不失为一家好公司~
华润双鹤的现金占比较低,平均收现是105天,也高于行业均值,且100/100/10 指标中也是很多不达标的情况 ,所以得分最低,
恩华药业的现金占比很高,平均收现也相对较快。达到了75天,小于行业均值,但100/100/10这个指标中多有不达标数值,且OCF数值较小,还是略逊一筹的~~
总结,在现金流量 板块中判断?
恒瑞医药 > 信立泰 > 恩华药业 > 华润双鹤?
二,经营能力板块
从总资产周转率来看四家公司,三家都是烧钱的企业,只有恩华药业 五年数据都大于 1,总资产周转率较高,代表企业经营能力很强,化学制剂行业存货平均周转天数是132天,按这个标准来说,四家公司都基本符合,且恩华药业的存货周转天数和完整生意周期都是数值最小的,所以这一轮恩华药业胜出~
观察到 信立泰 的2017年存货周转天数(125天)比2016年(183天)有大幅度增加,导致完整生意周期天数也大增,去它的年报查看了下原因,原来是本期子公司生产增大及年末备货导致的~
经营能力结语: 恩华药业 > 华润双鹤 > 恒瑞医药 > 信立泰
三,盈利能力板块
盈利能力的七个数据看下来,恩华药业,华润双鹤 和 恒瑞医药及信立泰 都不在一个级别上了,恒瑞医药及信立泰的 股东报酬率 平均在22%以上,达到巴菲特的选股标准,而恩华药业 及华润双鹤平均在12%以上;毛利率 恒瑞医药及信立泰平均在75%以上,毛利堪比卖白粉,而恩华药业及华润双鹤平均在43%以上;净利率 恒瑞医药及信立泰平均在22%以上,而恩华药业和华润双鹤平均在9%以上~
信立泰和恒瑞医药比起来,经营安全边际率比恒瑞医药高,毛利虽然不及恒瑞医药高,但净利率却高于恒瑞医药,说明企业费用率控制得很好,每股收益1.35 也高于恒瑞医药~
盈利能力板块结语:信立泰 > 恒瑞医药 > 华润双鹤 >? 恩华药业
四,财务结构板块
从整体数据来看,四家公司的指标全都达标,基本都没有什么负债,代表股东都比较看好企业发展,且长期资金都很充裕,完全能够负担企业成长所需~
按照优中选优,财务结构板块结语:恒瑞医药 > 信立泰 > 华润双鹤 >? 恩华药业
五,偿债能力板块
从整体数据来看,前三家公司的指标全都达标,偿还外债及快速 偿还外债能力都很强,不惧市场风险,尤其是恒瑞医药及信立泰的数据 更是高出判断标准好几倍,代表确实是不差钱的公司,只是恩华药业的数据有几项没达标,说明公司的还债能力还有待提高 ~
最后,偿债能力板块结语:恒瑞医药 > 信立泰 > 华润双鹤 >? 恩华药业
看了一眼 ,股价也很热,需要加入备选 池中继续观察。。。。
下面还是来简单了解一下这三家公司吧,看看实际生活中我们能看到这三家公司的产品吗?
1,江苏恒瑞医药:
是一家从事医药创新和高品质药品研发、生产及推广的医药健康企业,创建于1970年,2000年在上海证券交易所上市,截至2016年底,全球共有有员工12000多人,市值超千亿元,是国内知名的抗肿瘤药、手术用药和造影剂的供应商,也是国家抗肿瘤药技术创新产学研联盟牵头单位,建有国家靶向药物工程技术研究中心、博士后科研工作站,获得国家重大专项课题28项。
主要产品包括::盐酸右美托咪定、磺达肝癸钠、顺阿曲库铵、肿瘤药品、制剂出口产品、加巴喷丁、碘克沙醇、麻醉产品
2,深圳信立泰:
深圳信立泰药业股份有限公司成立于1998年11月,主要生产经营化学原料药、粉针剂、片剂和胶囊等产品,是一家集研发、生产、销售于一体的高新技术合资企业。公司主营业务为心血管类、头孢类抗生素、骨吸收抑制剂类等药物的研发、生产和销售. 以开发国家一、二类新药为主,主攻心血管、抗感染、抗过敏及抗肿瘤等治疗领域,研究开发具有自主知识产权的医药产品。二类新药硫酸氢氯吡格雷片(泰嘉)和地氯雷他定片(信敏汀)被认定为国家重点新产品。
公司产品包括制剂和原料药两大类.现有主要制剂产品包括硫酸氢氯吡格雷片(泰嘉)、盐酸贝那普利片(信达怡)、注射用盐酸头孢吡肟(信力威)、注射用头孢呋辛钠(信立欣)、注射用头孢西丁钠(信希汀)、注射用帕米膦酸二钠(信尔怡)等;原料药产品主要包括盐酸头孢吡肟、头孢呋辛钠、头孢西丁钠等. 明星产品包括有:心血管专科药、艾力沙坦、左心耳封堵器、苯甲酸复格列汀、医疗器械平台、仿制药、心血管器械 。
3,成都康弘药业:
公司创建于1998年10月8日,并于2015年6月26日上市。公司秉承“康平盛世、弘济众生”的企业宗旨,致力于“研发、制造、销售及传播专业创新的医药产品。
主营业务:持续专注于医药行业致力于中成药、化学药及生物制品的研发、生产和销售
产品名称:康柏西普眼用注射液(眼科领域) 、
? 松龄血脉康胶囊(中枢神经领域) 、
? 盐酸文拉法辛胶囊 (抑郁症治疗,一线专利药)、缓释片?、
? 阿立哌唑片及口崩片(治疗精神分裂症,专利) 、
? 右佐匹克隆片(治疗失眠) 、
?舒肝解郁胶囊(治疗中轻度抑郁症) 、
?胆舒胶囊 (治疗肝胆疾病)、
?枸橼酸莫沙必利片及分散片 (治疗功能性消化不良的第三代专利药)、
一清胶囊?、感咳双清胶囊?、渴络欣胶囊?、玄麦甘桔胶囊
公司在中成药、化学药方面有显著市场优势!
总体说来,医药域对于自己还是很陌生的一个领域,那些专业化的名词也很绕口,但通过简单查查资料还是多少对这三家公司有了初步的印象,如果确定投资方向的话肯定是还需要全方位的深入探究~~~
北京双鹭药业股份有限公司的辉煌历程
联邦制药引进先进的制药技术并积极推出创新产品,包括医药中间体、化学原料药、化学制剂、传统中药和生物制品产品涉及多个治疗领域,如抗生素类、解热镇痛类、抗组胺类、抗病毒类、心血管类等。可生产多种剂型的制剂并且年生产能力为胶囊12亿粒以上,片剂4.8亿片,颗粒剂7500万包以上,混悬剂2000万包,口服液900万瓶以上,粉针剂3000万瓶,软膏剂1300万支,冻干原料50吨,滴眼剂1500万支,注射剂3500万瓶。
联邦制药荣登2011年度中国制药工业百强榜 第十四位 。
2012年10月23日,联邦制药的包括注射用美罗培南在内的共12个品种一次性无任何缺陷通过美国FDA现场检查。无菌粉针制剂(注射用美罗培南)通过FDA检查,使得联邦制药成为中国大陆第一家粉针通过FDA检查的企业,也是继江苏恒瑞水针剂、成都康宏赛金冻干剂之后,第三家通过FDA检查的注射剂企业。
联邦制药此次通过FDA现场检查的品种包括:1个无菌粉针制剂(注射用美罗培南),5个无菌原料药(美罗培南混粉、头孢塞污钠、头孢曲松钠、头孢呋辛钠、头孢哌酮钠),6个非无菌原料药(阿莫西林、阿莫西林重粉、氨苄西林、非无菌舒巴坦钠、非无菌美罗培南、克拉微酸钾微晶纤维素)等,共涉及14个车间。
此次通过FDA现场检查意义重大,其在增加联邦制药品牌价值的同时,也增强了投资者信心。与此同时,通过FDA检查标志着联邦制药的GMP管理达到国际先进水平,为联邦制药加快国际化进程,走向国际高端医药市场奠定了坚实的基础,未来联邦制药将有更多高端产品进入国际市场。
[1994 年 12月] 北京白鹭园生物技术有限责任公司在北京八大处高科技园区成立;
[1995年 5月] Ⅰ期工程竣工;
6月 开始二类新药粒生素(rhG-CSF)的中试;
10月 粒生素通过中国药品检定所检定;
[1996年 6月] 卫生部批准粒生素人体临床试验;
[1997年 6月] 欣吉尔(125AlaIL-2)被卫生部批准临床试验;
10月 扶济复(rh-bFGF)被卫生部批准临床试验,并被列入国家863计划;
10月 Ⅱ期工程开工建设, 公司取得《药品生产企业许可证》
[1998年 5月] 粒生素获得新药证书和批准文号;
8月 Ⅱ期工程竣工,公司更名为北京双鹭药业有限责任公司;
[1999年 3月] 欣吉尔获得新药证书并正式投产;
9月 rhIL-11通过中国药品生物制品检定所检定;
11月 rhG-CSF被列为国家重点新产品
12月 rhG-CSF获北京市科技进步二等奖;
[2000年 1月] 公司粒生素和欣吉尔生产车间通过中国药品质量认证(GMP认证);
2月 rh-bFGF被列为国家863计划重大产业化项目;
粒生素、欣吉尔被北京市政府评为科技之光优秀产品奖;
3月 一类新药rh-bFGF获新药证书并投放市场;rhIL-11被国家药品监督管理局批准临床研究。
4月 rh-bFGF被列入国家级火炬计划并获国家创新基金资助;
4月 百克级中试工艺及临床研究被列为国家863计划基金资助项目(项目编号:Z18-03-27)。
6月 欣吉尔被列为国家重点新产品,获北京市科技进步二等奖;
7月 通过科技部和中科院组织的高新技术企业认定(双高认定);
8月9日 经北京市人民政府批准,北京双鹭药业股份有限公司成立。
12月 注射用重组人新型白介素-2获北京市科技进步二等奖。 [2001年1月] 注射用重组人新型白介素-11获国家企业技术创新基金资助。
9月 注射用重组人新型白介素-11被列入国家级火炬计划。
12月 双鹭医药生物技术中心被北京市认定为市级企业技术中心。
12月 重组人碱性成纤维细胞生长因子获北京市科技进步一等奖。 [2002年3月] 双鹭牌红欣生血胶囊获国家卫生部国产保健食品批准证书和《卫生许可证》。
4月 一类新药扶济复(重组人碱性成纤维细胞生长因子)获正式生产批文。公司获准设立企业博士后工作站。
5月 利塞膦酸钠及片(5mg、30mg)获临床研究批文;
9月 立生素(重组人粒细胞集落刺激因子)获北京市名牌产品和质量管理先进单位称号,公司Ⅲ期工程竣工。
11月 公司外用重组人碱性成纤维细胞生长因子,冻干粉针剂,片剂,胶囊剂、颗粒剂通过中国药品质量认证(GMP)认证。
12月 公司新型干扰素和甲状旁腺激素2个项目获国家十五重大科技专项资助。 [2003年1月] 公司再次通过GMP认证。
3月 二类新药迈格尔(白介素-11)在国内第一家获新药证书和生产批文。
3月 雷宁(氯雷他定分散片)、固通宁(鲑鱼降钙素注射液)获生产批文。
4月 重组人新型复合α干扰素(122Arg)注射液获临床研究批文(批件号:2003L00337)
4月 鲑鱼降钙素注射液(项目编号:031200022B)被列入北京市高新技术成果转化项目
5月 注射用苦参碱获生产批文(国药准字H20030735)
6月 替米沙坦胶囊及片获临床研究批文,批件号:2003L02074和2003L02073
6月 复方盐酸二甲双胍片获临床研究批文,批件号:2003L02130
8月 替莫唑胺胶囊 化药二类 获临床研究批文,批件号:2003L03265
9月 醋酸奥曲肽注射液获临床研究批文
10月 注射用庚铂 化药二类 获临床研究批文,批件号:2003L03752
10月 二类新药扎来普隆及胶囊获得生产,批准文号:国药准字H20031054
11月 重组新型复合干扰素在预防和治疗非典型肺炎中的应用发明专利初步审查合格.
12月 徐明波总经理被评为第十三届北京优秀青工程师标兵。 [2004年1月] 公司再次通过药品GMP认证,证书编号F2850.认证范围:片剂、胶囊剂、原料药(鲑鱼降钙素)
1月 人甲状旁腺激素基因突变体合成、表达、制备及应用国家知识产权局发明专利进入实审程序(专利公开号:CN1465703A )
1月 创面延迟愈合发生机制与促愈合基因工程一类新药的研发与应用获得国家科技进步二等奖。
3月 溶菌酶含片获国家食品药品监督管理局生产批文
3月 重组人白细胞介素-2注射剂水针获得国家食品药品监督管理局药品注册批件及新药证书.
国药准字S20040020及国药证字S20040014。
4月 抗艾滋病新药:司他夫定荣获北京市科学技术进步三等奖。
5月 奈哌地尔片、依托度酸缓释片、注射用亚叶酸钙获SFDA生产批准文号。
9月 公司在深圳证券交易所成功上市。
9月 硫酸奈替米星注射液获国家食品药品监督管理局药品注册批件。
10月 替米沙坦片剂、原料药,盐酸托烷司琼胶囊、原料药获国家食品药品监督管理局药品注册批件及新药证书;注射用胸腺五肽、原料药获国家食品药品监督管理局药品注册批件。
11月 二甲双胍格列本脲片(Ⅰ)获国家食品药品监督管理局药品注册批件及新药证书。 [2005年1月] 注射用头孢他啶获生产批文(国药准字H20053045)
2月 “重组人白介素-11的研制和应用”获北京市科学技术进步三等奖
羟喜树碱注射液获生产批文(国药准字H20053666)
立生坦(溶菌酶肠溶片)获生产批文
3月 生长抑素、注射用生长抑素获生产批文
欣复赛(利巴韦林片)获生产批文
4月 立生平(环孢素注射液)获生产批文
盐酸左氧氟沙星胶囊、盐酸克林霉素注射液、注射用头孢曲松钠获生产批文
5月 公司被评为中关村科技园区“五年上台阶”海淀园“自主创新明星企业”
公司注册资本由6900万元增加至8280万元
立生安(盐酸格拉司琼注射液)获生产批文
7月 注射用亚叶酸钙(0.35g)获生产批文
8月 门冬酰胺酶、注射用门冬酰胺酶获生产批文
替米沙坦胶囊获新药证书及生产批文
9月 公司在全景网举行股权分置改革投资者网上交流会
注射用果糖二磷酸钠、盐酸伐昔洛韦获生产批文
10月 鲁宁(辛伐他汀片)获生产批文(国药准字H20058534)
注射用胸腺五肽(10mg)获生产批文(国药准字H20058462)
11月 公司完成股权分置改革
公司控股子公司双鹭立生获《药品生产许可证》(证书号:京HZ 20050020)
奥扎格雷获生产批文(国药准字H20058593)
立生威(注射用更昔洛韦)、立生舒(注射用头孢哌酮钠舒巴坦钠)获生产批文
12月 盐酸克林霉素胶囊、注射用奥扎格雷钠获生产批文
盐酸托烷司琼注射液获新药证书及生产批文 [2006年1月] 鲑降钙素注射液(2ml:20ug)获生产批文(国药准字H20060056)
2月 公司荣获北京市纳税A级企业称号
公司公布股票期权激励计划草案
尼麦角林、注射用尼麦角林获生产批文
氯雷他定分散片(5mg)获生产批文(国药准字H20060157)
3月 注射用甲磺酸培氟沙星获生产批文(国药准字H20064252)
4月 克林霉素磷酸酯注射液、盐酸尼莫司汀(原料药)获生产批文
盐酸尼莫司汀获新药证书(国药证字H20060284)
5月 阿奇霉素颗粒/胶囊、阿魏酸钠氯化钠注射液获生产批文
6月 注射用门冬酰胺酶、注射用盐酸尼莫司汀、注射用头孢尼西钠、注射用炎琥宁获生产批文
注射用重组人白介素-2 注射液(150万)IU获生产批文(国药准字S20060054)
7月 公司一类生物制品“注射用重组人甲状旁腺激素”获临床试验批件(批件号:2006L01495)
欣尔金(紫杉醇注射液)获生产批文(国药准字H20066640)
盐酸伐昔洛韦片、灭菌注射用水获生产批文
8月 欣瑞金(酒石酸长春瑞滨注射液)获生产批文(国药准字H20067722)
9月 重组人粒细胞集落刺激因子注射液(250ug/瓶)获生产批文(国药准字S20063116)
10月 公司董事长、总经理徐明波先生获北京市第三届优秀青年企业家(金奖)称号
11月 公司限售股份首次上市流通,实际可上市流通股份数量为1,063.17万股 [2007年1月] 公司控股子公司双鹭立生获《药品GMP证书》(证书编号:H4111)
2月 公司荣获北京市纳税重点企业称号
立生素预充式新包装获国家食品药品监督管理局注册批件
4月 公司入选北京市中关村科技园区百家创新型试点企业
7月 注射用重组假丝酵母尿酸氧化酶获新药临床试验批件
10月 一类新药“注射用重组人甲状旁腺激素”进入II期临床研究
欧宁(胸腺五肽注射液)获生产批文(国药准字H20070219)
11月 注射用头孢呋辛钠(三规格)获生产批文(国药准字H20073775、H20073776、H20073777)
12月 外用重组人碱性成纤维细胞生长因子冻干粉针剂再次获《药品GMP证书》 [2008年1月] 徐明波董事长入选“新世纪百千万人才工程”国家级人选
4月 徐明波董事长荣获“2008年首都劳动奖章” 注射用重组人生长激素(4IU)获药物临床试验批件(批件号:2008L02056)
6月 公司获批技术改造国产设备投资抵免企业所得税
氨酚曲马多片、吗替麦考酚酯分散片获生产批件(国药准字H20080394、国药准字H20080403)
公司获得中关村科技园区海淀园创新发展二十年特别贡献奖
8月 阿德福韦酯胶囊、阿德福韦酯原料获生产批件(国药准字H20080497、国药准字H20080496)及新药证书(国药证字H20080202、国药证字H20080201)
公司受让的一类新药“818项目”原料和片剂获得临床批件(2008L4124、2008L4114)
9月 利塞膦酸钠片及原料获生产批文(国药准字H20080518、国药准字H20080515)
10月 注射用三氧化二砷获生产批文(国药准字H20080664)
12月 片剂、胶囊剂再次顺利通过GMP认证 [2009年3月] 公司及徐明波总经理双双荣获“中关村科技园区20周年突出贡献奖”
4月 奥美拉唑肠溶胶囊、环孢素软胶囊获生产批件(国药准字H20093308、国药准字H20093398)
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。