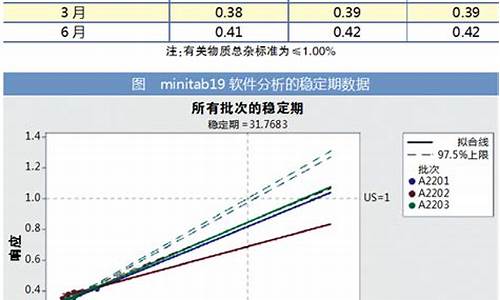
原料药品-原料药的原料备案法规

关于原料药是否可以自己公司注册标准而不执行国家标准的问题,需要明确以下几点:
首先,药品作为一种特殊的商品,其质量直接关系到公众的健康和安全。因此,各国政府都对药品的生产、销售和使用制定了严格的法律法规和标准。在中国,药品的生产必须遵循《药品管理法》等相关法律法规以及国家药品标准。
其次,原料药作为药品的重要组成部分,其质量同样受到严格的监管。原料药的生产企业需要根据国家药品标准制定自己的生产工艺和质量标准,并经过药品监管部门的审批和备案。这些标准通常会在国家药品标准的基础上,结合企业自身的实际情况进行细化和完善。
然而,这并不意味着原料药生产企业可以完全脱离国家标准自行制定标准。国家药品标准是保障药品质量的基础性、强制性标准,所有药品生产企业都必须遵守。原料药生产企业在制定自己的标准时,必须确保不低于国家药品标准的要求,以保证原料药的质量和安全性。
此外,值得注意的是,随着全球化和国际贸易的发展,许多原料药都用于出口。在这种情况下,原料药生产企业还需要关注国际药品标准,如ICH(国际人用药品注册技术协调会)标准等,以确保产品符合进口国的质量要求。
综上所述,原料药生产企业可以根据自身实际情况制定高于国家标准的生产工艺和质量标准,但绝不能低于国家标准。同时,在参与国际贸易时,还需要关注并符合国际药品标准的要求。
以上内容是由猪八戒网精心整理,希望对您有所帮助。
药品原料变更 备案多长时间
根据相关资料查询显示:
1、CDE平台备案需要提供原料药的企业名称和地址,与制剂共同审评审批的结果。
2、提供药品辅包的品种名称。
3、CDE平台是国家食品药品监督管理局药品注册技术审评机构,为药品注册提供技术支持,备案要有加工方的地址、执照以及卫生局的核验证明。
包材备案流程备案包材
5日内未告知的,自签收之日起即为受理。
包括申报药品历次获得的批准文件,应能够清晰了解该品种完整的历史演变过程和目前状况。
如药品注册证书、补充申请批件、药品标准制修订件、药物临床试验批准通知书等。
药品登记状态a和i是什么意思?
1、原料药登记状态为“I”有三种情况,第一是单独审评审批未通过,第二是未与制剂注册进行关联,第三是关联审评审批未通过。在原料药登记过程中,只要提交的资料通过审核,药审中心官网都可以查到该原料药,登记状态为“I”。在与药品进行关联审评审批时未通过,原料药登记状态还是显示为“I”,但这并不代表原料药质量不过关,有可能是药品审评不通过,待药品审评通过后,原料药登记状态才变为“A”。
2、标识为“A”的原料药发生技术变更的,按照现行药品注册管理有关规定提交变更申请,经批准后实施。原料药的其他交更应及时在登记平台更新信息,并在每年第一季度提交的上一年年度报告中汇总。
状态标识为“A”的原料药,按照药品进行上市后管理,并开展药品GMP检查。
缘生源的东西可靠吗?
是可靠的。
广州缘生源化妆品有限公司位于广州市白云区人和镇西城工业区,是一家集化妆品OEM/ODM/OBM研发制造、生产销售、策划服务于一体的实力型企业。致力于为客户量身定做自主品牌,从产品策划,产品设计、配方定制、包材选购、生产灌装、包装出货、送检备案,以市场为导向,以科技为依托,以质量求发展服务理念,为客户提供多样化的产品一站式的售后服务。
包材备案都需要准备什么啊?
一般是需要携带与身份相关的证明材料,比如身份证、户口本、营业执照、组织机构代码证等等。按备案性质准备:
1、性质为个人,提供资料:备案书面文档、网站负责人身份证、域名证书、备案核验单(个人签名)、照片。
2、性质为企业,提供资料:备案书面文档、网站负责人身份证、域名证书、备案核验单(负责人签名+盖公章)、照片外加营业执照。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。