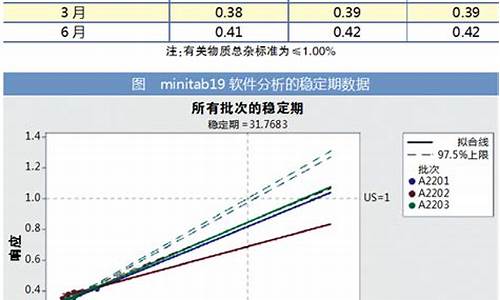
国家药品标准中原料药的含量-什么叫原料药执行标准

在药典上可以清晰的看出,由于制剂可能有辅料的干扰,所以一般尽量用高效液相来进行含量测定,而原料则可以用滴定法或紫外、荧光等来检测含量。但对于那些杂质紫外吸收和药品紫外吸收波长相同的原料也要用高效液相色谱法。
药品GMP认证以及GSP,GAP,GCP,GLP认证都是什么意思?
2019执业药师《药事管理与法规》每日冲刺
1. 关于药品说明书内容的说法,错误的是
A.药品说明书应当列出全部活性成分或者组方中的全部中药药味
B.非处方药说明书应当列出所用的全部辅料名称
C.注射剂的说明书应当列出所用的全部辅料名称
D.口服缓释制剂的说明书应当列出所用的全部辅料名称
2. 说明书用法用量项下要求的内容不包括
A.用药的剂量 B.用药次数
C.疗程期限 D.药品的装量
3. 说明书用法用量项中的内容不包括
A.用药的剂量 B.中毒剂量
C.计量方法 D.疗程期限
4. 下列药品有效期标注格式,错误的是
A.有效期至?/?/ B.有效期至年?月?日
C.有效期至.?. D.有效期至/?/?
5. 以下有关药品商品名称规定的表述,正确的是
A.药品商品名称的字体颜色应当使用黑色或者白色
B.药品商品名称的字体以单字面积计不得大于通用名称所用字体的四分之一
C.药品通用名称的字体和颜色不得比药品商品名称更突出和显著
D.药品商品名称不得与通用名称同行书写
6 根据《药品说明书和标签管理规定》,在药品说明书中应列出全部辅料名称的是
A.处方药 B.品和第一类精神药品
C.获得中药一级保护的中药品种 D.注射剂
7. 说明书药品名称项中所列顺序正确的是
A.通用名称、汉语拼音、商品名称、英文名称
B.通用名称、商品名称、英文名称、汉语拼音
C.通用名称、商品名称、汉语拼音、英文名称
D.通用名称、英文名称、商品名称、汉语拼音
8. 一般不在说明书注意事项项中说明的是
A.需要慎重的情况 B.影响药物疗效的因素
C.禁止应用该药品的疾病情况 D.用药过程中需观察的情况
配伍选择题
[9-10]
A.药品说明书 B.药品外标签
C.运输包装的标签 D.原料药标签
9. 应当列出全部活性成分或者组方中的全部中药药味的是
10. 应当注明药品名称、贮藏、生产日期、产品批号、有效期、执行标准、批准文号、生产企业等内容的是
[11-12]
A.有效期 B.规格
C.产品批号 D.执行标准
11. 原料药标签的内容不包括
12. 药品内标签的内容不包括
[13-14]
A.药品的外标签 B.药品的内标签
C.用于运输、储藏的药品的包装标签 D.原料药的标签
13. 至少应当标注药品通用名称、规格、产品批号、有效期等内容的标签是
14. 至少应当注明药品名称、贮藏、生产日期、产品批号、有效期、执行标准、批准文号、生产企业等内容的标签是
参考答案及解析
1答案D。解析:本题主要考查药品说明书管理规定。关于药品说明书中所列内容的要求为:①列出全部活性成分或者组方中的全部中药药味;②注射剂和非处方药列出所用的全部辅料名称;③处方中含有可能引起严重不良反应的成份或者辅料的,应当在注意事项予以说明。故本题选D。
2答案D。解析:本题主要考查药品说明书管理规定。用法用量应当包括用法和用量两部分。需按疗程用药或者规定用药期限的,必须注明疗程、期限。应当详细列出该药品的用药方法,准确列出用药的剂量、计量方法、用药次数以及疗程期限,并应当特别注意与规格的关系。故选D。
3答案B。解析:本题主要考查药品说明书管理规定。药品说明书用法用量项中的内容不包括中毒剂量,故选B。
4答案A。解析:本题主要考查药品标签管理规定。药品标签上药品有效期格式:(1)"有效期至年?月""有效期至.?.";(2)"有效期至年?月?日""有效期至/?/?"。故B、C、D正确,A错误。
5答案D。解析:本题主要考查药品名称使用要求。(1)药品通用名称应当显著、突出,其字体、字号和颜色必须一致,并符合以下要求:①对于横版标签,必须在上三分之一范围内显著位置标出;对于竖版标签,必须在右三分之一范围内显著位置标出;②不得选用草书、篆书等不易识别的字体,不得使用斜体、中空、阴影等形式对字体进行修饰;③字体颜色应当使用黑色或者白色,与相应的浅色或者深色背景形成强烈反差;④除因包装尺寸的限制而无法同行书写的,不得分行书写。(2)药品商品名称不得与通用名称同行书写,其字体和颜色不得比通用名称更突出和显著,其字体以单字面积计不得大于通用名称所用字体的二分之一。故选D。
6答案D。解析:本题主要考查药品说明书和标签管理规定。关于药品说明书中所列内容的要求为:①列出全部活性成分或者组方中的全部中药药味;②注射剂和非处方药列出所用的全部辅料名称;③处方中含有可能引起严重不良反应的成份或者辅料的,应当在注意事项予以说明。答案选D。
7答案B。解析:本题主要考查药品说明书管理规定。化学药品和治疗用生物制品的药品名称按下列顺序列出:通用名称、商品名称、英文名称、汉语拼音。故选B。
8答案C。解析:本题主要考查药品说明书管理规定。注意事项列出使用时必须注意的问题,包括:①需要慎用的情况(如肝、肾功能的问题);②影响药物疗效的因素(如食物、烟、酒);③用药过程中需观察的情况(如过敏反应,定期检查血象、肝功、肾功);④用药对于临床检验的影响等。禁忌中应当列出禁止应用该药品的人群或者疾病情况。故选C。
[9-10]答案AD。解析:本题主要考查药品说明书管理规定。(1)关于药品说明书中所列内容的要求为:①列出全部活性成分或者组方中的全部中药药味;②注射剂和非处方药列出所用的全部辅料名称;③处方中含有可能引起严重不良反应的成份或者辅料的,应当在注意事项予以说明。(2)原料药的标签应当注明药品名称、贮藏、生产日期、产品批号、有效期、执行标准、批准文号、生产企业,同时还需注明包装数量以及运输注意事项。故选A、D。
[11-12]答案BD。解析:本题主要考查药品标签管理规定。(1)原料药标签标示的内容包括:药品名称、贮藏、生产日期、产品批号、有效期、执行标准、批准文号、生产企业,同时还需注明包装数量以及运输注意事项。(2)药品的内标签标示的内容包括:药品通用名称、适应症或者功能主治、规格、用法用量、生产日期、产品批号、有效期、生产企业。(3)药品外标签标示的内容包括:药品通用名称、成分、性状、适应症或者功能主治、规格、用法用量、不良反应、禁忌、注意事项、贮藏、生产日期、产品批号、有效期、批准文号、生产企业。(4)运输、储藏包装标签标示的内容包括:药品通用名称、规格、贮藏、生产日期、产品批号、有效期、批准文号、生产企业,也可以根据需要注明包装数量、运输注意事项或者其他标记。故选B、D。
[13-14]答案BD。解析:本题主要考查药品标签管理规定。(1)内标签包装尺寸过小无法全部标明的,至少应当标注药品通用名称、规格、产品批号、有效期。(2)原料药的标签应当注明药品名称、贮藏、生产日期、产品批号、有效期、执行标准、批准文号、生产企业,同时还需注明包装数量以及运输注意事项。故选B、D。
?
cgmp认证是什么意思
1、GMP认证:药品生产质量管理规范。是药品生产和质量管理的基本准则,适用于药品制剂生产的全过程和原料药生产中影响成品质量的关键工序。大力推行药品GMP,是为了最大限度地避免药品生产过程中的污染和交叉污染,降低各种差错的发生,是提高药品质量的重要措施。
2、GSP认证:药品经营质量管理规范。它是指在药品流通过程中,针对计划采购、购进验收、储存、销售及售后服务等环节而制定的保证药品符合质量标准的一项管理制度。其核心是通过严格的管理制度来约束企业的行为,对药品经营全过程进行质量控制,保证向用户提供优质的药品。
3、GAP认证:中药材生产质量管理规范。是为确保中药材的质量而定。从生态环境、种植到栽培、采收到运输、包装,每一个环节都要处在严格的控制之下。?
4、GCP认证:药物临床试验质量管理规范。是规范药品临床试验全过程的标准规定,其目的在于保证临床试验过程的规范,结果科学可靠,保护受试者的权益并保障其安全。
5、GLP认证:药物非临床研究质量管理规范。制定GLP的主要目的是严格控制化学药品安全性评价试验的各个环节,即严格控制可能影响实验结果准确性的各种主客观因素,降低试验误差,确保实验结果的真实性。
扩展资料:
质量保证系统应当确保:
(一)药品的设计与研发体现本规范的要求;
(二)生产管理和质量控制活动符合本规范的要求;
(三)管理职责明确;
(四)采购和使用的原辅料和包装材料正确无误;
(五)中间产品得到有效控制;
(六)确认、验证的实施;
(七)严格按照规程进行生产、检查、检验和复核;
(八)每批产品经质量受权人批准后方可放行;
(九)在贮存、发运和随后的各种操作过程中有保证药品质量的适当措施;
(十)按照自检操作规程,定期检查评估质量保证系统的有效性和适用性。
百度百科-药品生产质量管理规范
百度百科-中药材生产质量管理规范
《中华人民共和国药典》通用技术要求中包括哪些内容?
CGMP认证表示该产品生产过程及质量符合CGMP标准,是确保产品质量稳定性、安全性和有效性的一种管理手段。
CGMP是CrrentGoodManfactrePractices的英文缩写,称为动态药品生产管理规范。要求在产品生产和物流的全过程都必须验证,是目前国际上相当严格的药品生产管理标准,也是目前美、欧、日等国执行的GMP规范,被称作“国际GMP规范”。
对产品的管理更为严格,更强调生产过程中的管理。
知识扩展:
cGMP指动态药品生产管理规范,英文名 Current Good Manufacture Practices的缩写,也译作现行药品生产管理规范。它要求在产品生产和物流的全过程都必须验证,cGMP是国际药品生产管理标准。
发展历史
无论是美国还是欧洲,生产现场的cGMP符合性检查所遵循的是国际协调会议(ICH)所制定的原料药统一cGMP规范,又称ICH Q7A。该规范起源于1997年9月瑞士日内瓦原料药国际协调会议(ICH for API)。
1998年3月,由美国FDA牵头,起草了统一的“原料药cGMP”即ICH Q7A。
1999年秋,欧盟和美国达成了原料药的cGMP互认协议,双方同意协议生效后,在原料药的贸易过程中,相互承认对方的cGMP认证结果。对于原料药企业来说,cGMP规范实际上就是ICH Q7A的具体内容。
所谓动态药品生产管理规范,就是强调现场管理(Current),cGMP的内容特别是在对现场工作部分的规范并没有深奥的学问,但是一旦将cGMP规范落实到工作中,执行起来并不简单。
中华人民共和国药典通用技术要求包括药典收载的通则、指导原则以及生物制品通则和相关总论等。
通则主要包括制剂通则、其他通则、通用检测方法,指导原则是为规范药典执行、指导药品标准制修订、提高药品质量控制水平所规定的非强制性、推荐性技术要求。
中华人民共和国药典
中华人民共和国药典是药品集中的技术法规,是药品研制、注册、生产、经营、使用和监督检验等行为的技术依据。它主要根据药物的重要性和使用中需要注意的事项,按系统化、标准化、规范化的原则,对药品的名称、成分、规格、质量标准、检验方法等进行规定。
中华人民共和国药典通用技术要求主要包括安全性、有效性、可控性和依从性四个方面的内容。
1、安全性方面,关注药物对人体正常功能的影响,包括不良反应、禁忌症、注意事项等。
2、有效性方面,关注药物对疾病的治疗效果,包括适应症、用法用量、疗效等。
3、可控性方面,关注药物的质量控制和稳定性,包括原料药和制剂的质量标准、稳定性考察等。
4、依从性方面,关注药物的方便使用和患者的依从程度,包括剂型设计、给药途径、包装和贮藏等。
总的来说,《中华人民共和国药典》通用技术要求涵盖了药品的整个生命周期,包括从研发到上市后监督的各个阶段,以保证药品的安全、有效、可控和方便使用。
药品相关技术法规
1、药品注册标准:是指国家食品药品监督管理局批准的药品注册时所采用的标准。该标准是药品研制、生产、经营、使用和监督管理的重要依据。
2、药品生产质量管理规范(GMP):是为了保证药品生产过程的质量和安全,规范药品生产行为而制定的法规。它规定了药品生产的厂房、设施、设备、生产工艺、卫生等方面的要求,以确保药品的质量和安全。
3、药品经营质量管理规范(GSP):是为了保证药品经营过程的质量和安全,规范药品经营行为而制定的法规。它规定了药品经营企业的资质、采购、验收、储存、运输等方面的要求,以确保药品的质量和安全。
4、药品非临床研究质量管理规范(GLP):是为了保证药品非临床研究结果的真实性和可靠性而制定的法规。它规定了药品非临床研究的组织机构、研究人员、实验设施等方面的要求,以确保药品的安全性和有效性。
5、药品临床研究质量管理规范(GCP):是为了保证药品临床研究结果的真实性和可靠性而制定的法规。它规定了药品临床研究的组织机构、研究人员、实验设施等方面的要求,以确保药品的安全性和有效性。
6、放射品管理办法:是为了保证放射品的安全和有效而制定的法规。它规定了放射品的生产、经营、使用等方面的要求,以确保放射品的安全和有效。
7、品和精神药品管理条例:是为了保证品和精神药品的安全和有效而制定的法规。它规定了品和精神药品的生产、经营、使用等方面的要求,以确保品和精神药品的安全和有效。
除此之外,还有许多其他的药品相关技术法规,如中药品种保护条例、生物制品批签发管理办法等。这些法规都是为了保障公众用药安全和合法权益而制定的。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。