原料药包装规格变更-药品改变包装

就个人而言,一般想要快速鉴别是不是假药。可以看一眼药品外包装,就能识别一些假药, 需要看的,有三点: 1. 看包装:最简单的是看外包装(包装盒或瓶装的标签)的印刷质量,正规厂家出厂的药品包装盒或标签上,字体印刷清晰,不会出现字迹模糊的情况。而如果发现印刷质量特别差,文字出现很多叠影,就要怀疑一下是否小作坊出品的假劣药。 2. 看药名:有些假药会打一个看上去靠谱的幌子,比如药名为「柏芪降糖胶囊(糖必清)」,这就有很大问题。因为按规定,通用名(柏芪降糖胶囊)和商品名(糖必清)不可以放在同一行,而且商品名也不可以加括号。 3. 看批号:看包装盒或瓶子标签上是否写明「药品名称」「规格」和「生产批号」,这三项只要少了任何一项,就该怀疑是假药。
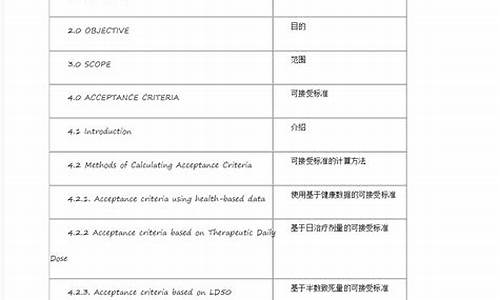
同一注册申请包括不同包装规格时,可以只进行
原料药标签属于药品的外包签
外标签指内标签以外的其他包装的标签。
例如:药瓶上印的内容就是内标签,装药瓶的盒子上印的内容是外标签,大包装的大药盒子、牛皮纸盒子所印的内容也属于外标签。
内标签至少应当标注药品通用名称、规格、产品批号、有效期等内容。
标题原料药标签上为什么没有成分,适应症,用法用量等内容
同一注册申请包括不同包装规格时,可以只进行一种包装规格产品的检验。
同一注册申请包括不同包装规格时,可以只进行一种包装规格产品的检验。对于体外诊断试剂注册申请,如果同一注册申请包含不同包装规格的产品,申请人可以选择对一种包装规格产品进行注册检验,而其他包装规格产品应当在生产质量体系中进行审查和检验。
这种做法可以降低申请人的成本和风险,提高注册效率。但是,需要注意的是,只进行一种包装规格产品检验并不意味着其他包装规格产品不需要符合相关法规和标准要求。申请人仍然需要确保所有包装规格产品的安全性和有效性,并遵守医疗器械生产质量管理规范的相关要求。
此外,在产品上市后,监管部门仍然可以对其他包装规格产品进行监督检查和抽样检验等措施,确保其符合相关法规和标准要求。因此,申请人应该认真履行自己的主体责任,保证产品的安全性和有效性,遵守相关法规和标准要求。
需要注册的产品:
1、药品。药品中包括中药材、中药饮片、中成药、化学原料药及其制剂、抗生素、生化药品、放射品、血清、疫苗、血液制品和诊断药品等。
2、医疗器械。医疗器械包括体外诊断试剂,以及与医疗器械相关的组件和部件,如接触人体或动物组织的仪器、设备、器具、材料以及其他物品。
3、保健食品。包括声称具有特定保健功能或者以补充维生素、矿物质为目的的食品,即“蓝帽子”保健食品。
4、化妆品。需要注册的产品还有很多,如果您想了解更多信息,可以咨询相关部门或机构。
为什么药物一般都有个有效期
属于说明书内容。原料药标签内容包括药品名称、包装规格、生产批号、生产日期、有效期、贮藏、批准文号、生产企业及运输注意事项或别的标记,但是不包括成分、适应症、用法用量等,因这些属于说明书的内容。
药品包装、标签规范细则的具体要求
药品的有效期是受很多因素制约的,绝对不能简单地用阴谋论解释。我们可以把影响药品保质期的因素归为以下几类:1.质量因素。药品有效期受原料药和包材的影响比较大。国内外很多仿制药企使用的原料药和包装的材料都要比原研药物差很多,所制造的药品自然就要比原研药物有效期短,甚至只有原研药的一半或一小半。楼主所看到的药品基本可以归为此类。2.规格因素。一般同剂型药物剂量较大者有效期较长,如康忻(富马酸比索洛尔片)的2.5mg片剂有效期就明显短于5mg片剂(36个月:60个月)。3.剂型因素。通常液体剂型(如口服溶液、吸入用溶液、滴剂、注射液等)和口崩片的有效期较短。4.环境限制。生物制品、含放射性核素药品等药物需要遵照特殊条件保存,否则有效期会明显缩短。另外注射剂配置后有效期缩短为8~48小时,非一次性滴眼液开封后有效期缩短为30天,一次性滴眼液开封后有效期仅有3~5小时。5.药品自身因素。例如各种生物制品(疫苗、免疫球蛋白、单克隆抗体、基因工程制品等)有效期为12~24个月,含放射性核素的药品(如氯化锶[89Sr]注射液、碘[131I]美妥昔单抗注射液等)有效期由自身所含有的放射性核素决定(通常为24小时~28天)。不过,以上原则仅仅能够限制住化学药品和生物制品,中药的保质期是由药厂自行决定的,和以上因素完全无关哦~
麻烦采纳,谢谢!
根据《药品说明书和标签管理规定》,关于药品标签管理的说法,正确的有
一、化学药品与生物制品、制剂:
(一)内包装标签内容包括:
药品名称、规格、适应症、用法用量、贮藏、生产日期、生产批号、有效期及生产企业。由于包装尺寸的原因而无法全部标明上述内容的,可适当减少,但至少须标注药品名称、规格、生产批号三项(如安瓿、滴眼剂瓶、注射剂瓶等)。
(二)直接接触内包装的外包装标签内容包括:
药品名称、成份、规格、适应症、用法用量、贮藏、不良反应、禁忌症、注意事项、包装、生产日期、生产批号、有效期、批准文号及生产企业。由于包装尺寸的原因而不能注明不良反应、禁忌症、注意事项,均应注明“详见说明书”字样。
对预防性生物制品,上述适应症项均应列为接种对象。
(三)大包装标签内容包括:
药品名称、规格、生产批号、生产日期、有效期、贮藏、包装、批准文号、生产企业及运输注意事项或其它标记。
二、原料药标签内容包括:
药品名称、包装规格、生产批号、生产日期、有效期、贮藏、批准文号、生产企业及运输注意事项或其它标记。
三、中药制剂:
(一)内包装标签内容包括:
药品名称、规格、功能与主治、用法用量、贮藏、生产日期、生产批号、有效期及生产企业。因标签尺寸限制无法全部注明上述内容的,可适当减少,但至少须标注药品名称、规格、生产批号三项,如安瓿、注射剂瓶等。中药蜜丸蜡壳至少须标注药品名称。
(二)直接接触内包装的外包装标签内容包括:
药品名称、成份、规格、功能与主治、用法用量、贮藏、不良反应、禁忌症、注意事项、包装、生产日期、生产批号、有效期、批准文号及生产企业。由于包装尺寸的原因而不能注明不良反应、禁忌症、注意事项,均应注明“详见说明书”字样。
(三)大包装标签内容包括:
药品名称、规格、生产批号、生产日期、有效期、贮藏、包装、批准文号、生产企业及运输注意事项或其它标记。
本细则自颁布之日起施行。
本细则由国家药品监督管理局负责解释。
答案:A、C
考查药品标签管理。其一,标签标注内容中,只有内标签在包装尺寸限制的情况下,可以只标明药品通用名称、规格、批号、有效期。运输、储藏包装的标签,至少应注明药品通用名称、规格、贮藏、生产日期、产品批号、有效期、批准文号、生产企业,也可以根据需要注明包装数量、运输注意事项或其他标记等必要内容。选项B说法错误。其二,药品外标签中适应症或功能主治、用法用量、不良反应、禁忌、注意事项不能全部注明的,应标出主要内容并注明“详见说明书”字样。选项D说法错误。其三,药品标签的种类分为药品标签,用于运输、储藏包装的标签,原料药包装标签、中药饮片的包装标签四类,药品标签包括内标签和外标签。选项C说法没问题。故答案为AC。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。