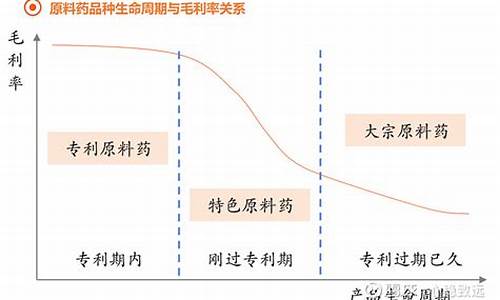
原料药百科-原料药是啥意思

一般用来形容原料药的标准。BP是英国药典,EP是欧洲药典,USP是美国药典。
相关介绍:
一、英国药典:
是英国药品委员会正式出版的英国官方医学标准集,是英国制药标准的重要出处,也是药品质量控制、药品生产许可证管理的重要依据。该药典囊括了几千篇颇有价值医学专题论文,其中有几百篇是医学新论。
二、欧洲药典:
为欧洲药品质量检测的唯一指导文献。所有药品和药用底物的生产厂家在欧洲范围内推销和使用的过程中,必须遵循《欧洲药典》的质量标准。
三、美国药典:
是由美国药典委员会编写的。美国药典是美国政府对药品质量标准和检定方法作出的技术规定,也是药品生产、使用、管理、检验的法律依据。NF收载了美国药典(USP)尚未收入的新药和新制剂。
扩展资料
药典是一个国家记载药品标准、规格的法典,一般由国家药品监督管理局主持编纂、颁布实施,国际典则由公认的国际组织或有关国家协商编订。
制定药品标准对加强药品质量的监督管理、保证质量、保障用药安全有效、维护人民健康起着十分重要的作用。药品标准是药品现代化生产和质量管理的重要组成部分,是药品生产、供应、使用和监督管理部门共同遵循的法定依据。
药品质量的内涵包括三方面:真伪、纯度、品质优良度。三者的集中表现是使用中的有效性和安全性。因此,药品标准一般包括以下内容:法定名称、来源、性状、鉴别、纯度检查、含量(效价或活性)测定、类别、剂量、规格、贮藏、制剂等等。
百度百科-英国药典
百度百科-欧洲药典
百度百科-美国药典
药店药品分哪几类
江苏百科医药有限公司是2005-12-14在江苏省盐城市东台市注册成立的有限责任公司(自然人投资或控股),注册地址位于东台市东台镇范公工业集中区2—5幢。
江苏百科医药有限公司的统一社会信用代码/注册号是91320981782726980D,企业法人丁书涛,目前企业处于开业状态。
江苏百科医药有限公司的经营范围是:药品[中成药、中药材、中药饮片、化学药制剂、化学原料药、抗生素原料药、抗生素制剂、生化药品、生物制品、精神药品(限二类)]、食品[预包装食品(除食盐),乳制品(含婴幼儿配方乳粉)]批发,食品(蔬菜)粗加工(限分支机构经营),医疗器械(按医疗器械经营企业许可证所列项目经营)、食品(保健食品)、清洁用品、化妆品销售,中药材收购(国家有专项审批规定的,待审批后方可经营),医疗器械研发,市场信息咨询服务。(依法须经批准的项目,经相关部门批准后方可开展经营活动)。在江苏省,相近经营范围的公司总注册资本为1384890万元,主要资本集中在100-1000万和1000-5000万规模的企业中,共4118家。本省范围内,当前企业的注册资本属于优秀。
江苏百科医药有限公司对外投资2家公司,具有0处分支机构。
通过百度企业信用查看江苏百科医药有限公司更多信息和资讯。
成分含量是什么意思
2类,甲类目录和乙类目录
《药品目录》通过甲类目录和乙类目录进行区别管理。甲类目录的药品除了符合上述条件外,应具备临床治疗必需、使用广泛、疗效好、同类药品中价格低等特点。
乙类药品是可供临床选择使用,疗效好,同类药品中比甲类价格略高的药品。基本医疗保险参保人员在诊疗过程中,使用甲类药品所发生的费用,由医保基金按规定支付,使用乙类药品所发生的费用,必须先由参保患者自付一定比例,再由医保基金支付。
扩展资料
据劳动和社会保障部有关同志介绍,《国家基本医疗保险药品目录》明确纳入目录的药品应是临床必需、安全有效、价格合理、使用方便、市场能够保证供应的药品。
不包括:主要起营养滋补作用的药品;部分可以入药的动物及动物脏器,干(水)果类;用中药材和中药饮片泡制的各类酒制品;各类药品中的果味制剂、口服泡腾剂;血液制品、蛋白类制品(特殊适应症与急救、抢救除外)。
人民网-甲类药品、乙类药品如何区分
标示量%和含量%有什么区别?
成分含量是指特定物质中某组成部分的量。成分指的是构成物体的个体物质,任一事物的组成部分。例:把问题分解成各种成分。构成化合物的元素或组成混合物的各部分物质。含量是指特定物质中所包含的某种成分的量,如:含金量,含铅量,含锌量等。
扩展资料:
药品含量
是指一种药品制剂中包含的国家标准规定的有效成分的数量.药品的含量或效价是评定药品的主要指标之一,设计其测定方法时,应根据药品特性、剂型、处方、鉴别试验和纯度检查综合考虑,当鉴别试验和纯度检查保证了专属性和纯度的情况下,含量测定方法的选择要着眼于准确性、稳定性和可重复性。?
原料药:对于组份单一的原料药,首选精密度高,操作简便、快速的容量法测定含量,可根据药物分子中所具有的官能团及其化学性质,选用不同的容量分析方法,但应符合如下条件:
(1)反应须按一个方向完全进行;
(2)反应要迅速,必要时可通过加热或加入催化剂等方法提高反应速度;
(3)共存物不得干扰主要反应,或能用适当方法消除;
(4)确定等当点的方法要简单、灵敏;
(5)标化滴定液所用基准物质易得,并符合纯度高、组成恒定且与化学式符合、性质稳定(标化时不发生副反应)等要求。
参考资料:百度百科-成分
参考资料:百度百科-含量
普尔敏的学名是什么
一:标示量%
标示量,指该剂型单位剂量的制剂中规定的主药含量,通常在该剂型的标签上表示出来。标示量%就是指每个样本的百分含量与标示量(100%)的偏离程度。
二:含量%
含量特定物质中所包含的某种?成分的量,含量%就单纯的指示某种成分占总成分的百分比,也就是用百分数的形式来表示,这个是个形式,也可用小数。
比如说某片剂,标示量为60mg,片重0.3g,就是说每片中理论上含主药60mg,它是理论值,与实际测得值有差异;原料药含量是其中所含主药的百分含量;两者的主体不同!一个是制剂,一个是原料药!
扩展资料:
标示量是一种产品的规定的含量,如10%的葡萄糖注射液。
但是,实际配制生产的时候,不可能就准确的配制成了10%的浓度,总是有误差的。这个误差究竟多大,然后就规定了一个误差的范围。
药典上规定大部分的注射液的浓度误差为标示量的95.0%-105.0% ,对于10%的葡萄糖注射液来说,这个浓度的误差下限就是9.5%,上限就是10.05%,在这个范围内的都是合格的药品。
百度百科-标示量%
百度百科-含量%
同一种药品,不同厂家的疗效有区别么?
马来酸氯苯那敏
普尔敏每片含主要成份马来酸氯苯那敏4毫克。辅料为糊精、淀粉、蔗糖、磷酸氢钙、羧甲淀粉钠、硬脂酸镁。
作为组胺H1受体拮抗剂,本品能对抗过敏反应(组胺)所致的毛细血管扩张,降低毛细血管的通透性,缓解支气管平滑肌收缩所致的喘息,本品抗组胺作用较持久,也具有明显的中枢抑制作用。
氯苯吡胺是最强的抗组胺药之一,镇静作用较异丙嗪弱,也有一定的抗胆碱作用。它与苯海拉明相似,但中枢抑制作用较轻。可诱发癫痫,禁用于癫痫患者。哺乳期妇女、青光眼、高血压、甲亢、前列腺肥大患者慎用。服药期间,不得驾驶车、船、飞机等机动车辆或操纵机器。
扩展资料
常用抗过敏药是抗组胺药,第一代抗组胺药是扑尔敏、苯海拉明、异丙嗪;第二代抗组胺药有氯雷他定、西替利嗪、依巴斯汀。组胺是人体过敏反应时释放的致敏物质。
第一代抗组胺药物的镇静与中枢神经不良反应较为明显,服用后会出现嗜睡、乏力、反应迟钝等症状,用药后应避免驾车、操作精密仪器、高空作业等。
此类药物还有抗胆碱作用,前列腺肥大、青光眼、肝肾功能低下者及老年患者应慎用。第二代抗组胺药物的中枢神经系统不良反应大为降低,对治疗儿童过敏性鼻炎也是安全有效的。
百度百科-扑尔敏片
人民网-抗过敏药最好随身带
小黄姜和黄姜一样吗?
不同品牌的同一种药物,虽然都符合法定的质量标准,疗效可能会存在差异。
1、主药纯度不同,同一种药物,其主要成分是相同的,但药品的纯度可能存在差异,不同厂家对药物研究的深入程度不同,特别是原料药的杂质控制情况不同,可能就会影响药物在体内的药效和不良反应发生率,导致出现疗效和不良反应方面的差异。
2、药物辅料不同,一个药物要制成制剂,除了要包含主要的药物成分以外,还要加入一定的辅料,拿口服固体制剂来说,要把药物做成药片,赋形剂、崩解剂、包衣剂等多种辅料就必不可少,而这些辅料的使用,会影响药物进入体内后的崩解、析出、吸收、代谢等多个方面的过程。
同一种药品,不同厂家在进行制剂研究时,选择的辅料可能会有所不同,即使是相同的辅料,质量上也可能会有差异,这些差异都有可能造成药物在体内溶出代谢过程的差异,进而药效当然也就会存在一定差异。
3、制剂工艺不同,液体制剂不同的投料顺序,采用不同的灭菌或除菌工艺参数,固体制剂采用不同的压片工艺等等都有可能最终导致我们使用的药品进入人体后,其代谢过程以及药物疗效产生一定的差异。
扩展资料:
如果不差钱,优先推荐进口的原研药,原研药在对药品研究的深入性,临床应用数据积累等方面,都具有仿制药不可比拟的优势,药品质量和疗效方面,通常也会更有保障,但缺点是进口药品一般价格较高。
对于需要考虑用药经济性,则不妨考虑国产的仿制药,但仿制药选择方面,也是有讲究的。国家药监局公布了我国通过一致性评价的仿制药,这些仿制药的质量和疗效都有保障,购买时认准仿制药一致性评价标签。
参考资料:
化学药品是怎样分类的?1类、2类、…6类药是怎样区分出来的?
1、分布不同
小黄姜分布广东的海南及雷州半岛、广西、云南、台湾等地。广东、云南并有栽培。产广东、广西、台湾等地。
姜黄产自中国台湾、福建、广东、广西、云南、西藏等省区;东亚及东南亚广泛栽培。
黄姜:
小黄姜:
2、属性不同
小黄姜味辛、性热;归脾;胃经。具有温胃散寒,消食止痛的功效。
姜黄性辛、苦,温。归脾、肝经。具有破血行气,痛经止痛。
3、属科不同
小黄姜是姜科、姜属的。
而黄姜是薯蓣科薯蓣属多年生草本植物,是世界上薯蓣皂苷元含量最高的种。
百度百科-小黄姜
百度百科-黄姜
根据国家药品监督管理局发布的《药品注册管理办法》(局令第28号),化学药品注册的需按照法规对申报药品进行分类。对于化学药品的注册分类共分为6类。原文可下载《药品注册管理办法》(局令第28号)的附件2查看。
1、未在国内外上市销售的药品。细分如下:
(1)通过合成或者半合成的方法制得的原料药及其制剂;
(2)天然物质中提取或者通过发酵提取的新的有效单体及其制剂;
(3)用拆分或者合成等方法制得的已知药物中的光学异构体及其制剂;
(4)由已上市销售的多组份药物制备为较少组份的药物;
(5)新的复方制剂;
(6)已在国内上市销售的制剂增加国内外均未批准的新适应症。
2、改变给药途径且尚未在国内外上市销售的制剂。
3、已在国外上市销售但尚未在国内上市销售的药品。细分如下:
(1)已在国外上市销售的制剂及其原料药,和/或改变该制剂的剂型,但不改变给药途径的制剂;
(2)已在国外上市销售的复方制剂,和/或改变该制剂的剂型,但不改变给药途径的制剂;
(3)改变给药途径并已在国外上市销售的制剂;
(4)国内上市销售的制剂增加已在国外批准的新适应症。
4、改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药及其制剂。
5、改变国内已上市销售药品的剂型,但不改变给药途径的制剂。
6、已有国家药品标准的原料药或者制剂。
扩展资料
化学药品制剂行业一直以来都是我国医药工业中的优势子行业,具有高技术含量、高资金投入、高风险、高收益和相对垄断的行业特征。从价值链来讲,化学药品制剂处于价值链高端,按价值递增依次为通用名药(非专利药)和专利药,专利药是整个价值链的顶端。
化学药品制剂涉及国民健康、社会稳定和经济发展,是国民经济一个特殊而重要的产业。改革开放30年以来,我国化学药品制剂工业的发展驶入快车道,近几年的工业总产值增长率都保持在18%以上,销售收入增长率基本保持在20%以上。
从发展趋势看,化学药品制剂行业即将进入快速发展期,未来发展空间巨大,但利润分配将更加不均衡,行业集中度将进一步提高,具有研发、规模和产品优势的企业将强者恒强。
中国化学药品制剂行业已经完全发展成为一个竞争性的行业,在国际上的影响力也有所提高。在中国内地,外资及合资制药企业与内资制药企业之间的市场竞争非常激烈,尤其是近两三年,外资及合资企业大幅增加在华投资,强化市场力度。
截至2011年底,中国大陆规模以上的化学药品制剂企业有1032家,经过快速发展阶段和激烈的市场竞争的锤炼,基本格局初步形成。外资及合资制药企业占据着中国化学药品制剂的高端市场,但内资品牌也正在逐步进军高端。
百度百科:化学药品
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。