原料药中间体要求GMP车间吗-生产原料药与中间体哪个污染大

“GMP”是英文Good Manufacturing Practice 的缩写,中文的意思是“良好作业规范”,或是“优良制造标准”,是一种特别注重在生产过程中实施对产品质量与卫生安全的自主性管理制度。它是一套适用于制药、食品等行业的强制性标准,要求企业从原料、人员、设施设备、生产过程、包装运输、质量控制等方面按国家有关法规达到卫生质量要求,形成一套可操作的作业规范帮助企业改善企业卫生环境,及时发现生产过程中存在的问题,加以改善。
GMP是《药品生产质量管理规范》(Good Manufacture Practice,GMP)的英文缩写,是对企业生产过程的合理性、生产设备的适用性和生产操作的精确性、规范性提出强制性要求。
几十年的应用实践证明,GMP是确保产品高质量的有效工具。因此,联合国食品法典委员会(CAC)将GMP作为实施危害分析与关键控制点(HACCP)原理的必备程序之一。1969年,世界卫生组织向世界各国推荐使用GMP。1972年,欧共体14个成员国公布了GMP总则。1975年,日本开始制定各类食品卫生规范。
GMP是药品生产和质量管理的基本准则,适用于药品制剂生产的全过程和原料药生产中影响成品质量的关键工序。大力推行药品GMP,是为了最大限度地避免药品生产过程中的污染和交叉污染,降低各种差错的发生,是提高药品质量的重要措施。世界卫生组织,60年代中开始组织制订药品GMP,中国则从80年代开始推行,十几年来,中国推行药品GMP取得了一定的成绩,一批制药企业(车间)相继通过了药品GMP认证和达标,促进了医药行业生产和质量水平的提高。但从总体看,推行药品GMP的力度还不够,药品GMP的部分内容也急需做相应修改。锭工赤继俦荒稠维椽哩
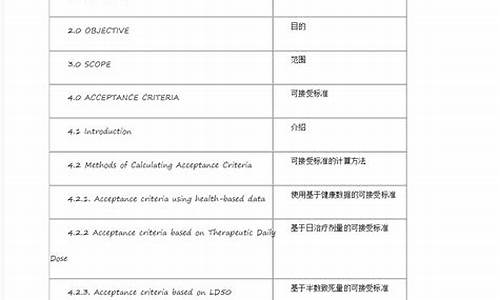
GMP是药品生产和质量管理的基本准则。我国自1988年第一次颁布药品GMP,其间经历1992年和1998年两次修订,截至2004年6月30日,实现了所有原料药和制剂均在符合药品GMP的条件下生产的目标。新版药品GMP共14章、313条,相对于1998年修订的药品GMP,篇幅大量增加。GMP所规定的内容,是食品药品加工企业必须达到的最基本的条件。GMP是指导药品生产和质量管理的法规。世界卫生组织于1975年11月正式公布GMP标准。国际上药品的概念包括兽药,化学药品,只有中国和澳大利亚等少数几个国家是将人用药GMP和兽药GMP分开的。
奥咨达医疗器械咨询机构
新药在未通过gmp车间做工艺验证,对车间设备系统的验证有什么要求
都是药监局管理里的,现在都是省局来进行认证。国内是遵循一个gmp,原料药还遵循gmp的原料药附录。
制剂认证一般是按剂型进行认证,原料药是按产品进行认证。发证书时也是,制剂按剂型发gmp证书,原料是按产品发gmp证书。
国外一般原料药认证是遵循ich
的q7。
生产医药中间体的企业需要获得药品生产许可证吗?
如果在没有过GMP的车间做验证,那就需要你所使用的工艺环境拿的出相应的验证报告,比如最基本的空调系统,要有全套的验证方案和验证报告支持,说明工艺房间内的各项参数都在GMP的数据要求之内;另外纯水、压缩空气、纯蒸普蒸等等都要有相关的证据证明满足GMP的要求。除公用系统外,你做工艺验证所用的设备也要有相应的满足GMP要求设备验证。这些验证都有,且数据满足要求,这样做出来的工艺验证数据才算是有效力,最终要的也是数据。
根据国家有关法律法规的规定:生产医药中间体的企业需要获得药品生产许可证。
一、必须具备的条件:生产医药中间体的企业必须具备的条件:
具有经过资格认证的药学技术人员、工程技术人员及相应的技术工人。
具有与其药品生产相适应的厂房、设施和卫生环境。
具有对所生产药品进行质量管理和质量检验的机构、人员以及必要的仪器设备。
具有保证药品质量的规章制度。
二、申请“许可证和GMP认证”:生产医药中间体的企业,申请人应当向省级药监部门提出申请筹建,筹建完成后,省局验收合格发给《药品生产许可证》,凭《药品生产许可证》到工商部门办理注册登记(营业执照),再向省局提出GNP认证,认证合格的发给GMP认证证书。
三、药品注册:获得《药品生产许可证》和GMP认证证书后。还需要有 所生产药品的 药品生产批准文号。这就是药品注册。有关药品注册的内容,请从网上下载新修定的《药品注册管理办法》。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。