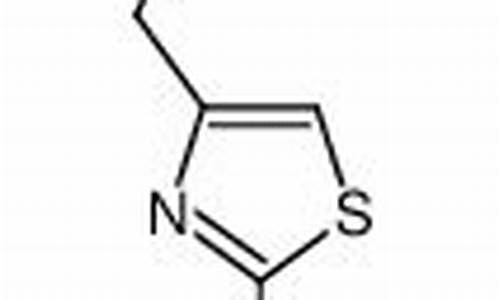
无菌原料药有哪些产品-无菌原料药有哪些产品呢

安全。根据查询国家药品监管局得知。非无菌制剂要求的生产环境非常严格,控制标准非常高。红霉素软膏就是非无菌制剂,是指为生产药品制剂而专门供应的化学物质。原料药作为两大剂量制药企业的上游产品,根据其药品需求可分为非无菌原料药和无菌原料药两大类。
无菌分装用原料药控制松紧密度原因
有必要。原因如下:1-如果是无菌产品,当然应该检验无菌项目,还应该检验药品标准含有的热原、内毒素等项目。
2-对于非无菌原料药,按照用途可以分为2种情况,
A--如果原料用于生产可以最终灭菌的针剂,那麽原料应该检查微生物限度。如果微生物限度负荷很高,及时最终产品经过灭菌工艺无菌检查合格,细菌尸体仍在产品里面,也不能避免热原或者内毒素项目不合格。
B--对于那些用于口服药品的原料,按照中国药典附录,制剂应该控制微生物限度,那麽原料当然应该控制微生物限度,否则制剂的微生物限度很难保证。
进行硬件施工,一定考虑周全,并且具有前瞻性,否则很容易被动。
中国药典无菌检查法的附表
保证无菌分装的质量,保证产品的稳定性。
1、松紧度不合适会导致原料药在分装过程中容易产生气泡、漏气问题,从而影响无菌分装产品的质量。因此,控制松紧度是保证无菌分装产品质量的重要措施之一。
2、松紧度不合适也会导致无菌分装产品在贮存、运输和使用过程中容易发生变形、破裂问题,从而影响产品的稳定性。因此,控制松紧度是保证无菌分装产品稳定性的重要措施之一。
关于化学原料药GMP厂房的问题
表1批出厂产品最少检验数量 供试品 批产量N(个) 接种每种培养基所需的最少检验数量 注射剂
大体积注射剂(>100 ml) ≤100
100<N≤500
>500 10%或4个(取较多者)
10个
2%或20个(取较少者)
2%或10个(取较少者) 眼用及其他非注射产品 ≤200
>200 5%或2个(取较多者)
10个 桶装无菌固体原料
抗生素固体原料药(≥5克) ≤4
4<N≤50
>50 每个容器
20%或4个容器(取较多者)
2%或10个容器(取较多者)
6个容器 医疗器具 ≤100
100<N≤500
>500 10%或4件(取较多者)
10件
2%或20件(取较少者) 注:若供试品每个容器内的装量不够接种两种培养基,那么表中的最少检验数量加倍。
(注:“抗生素固体原料药(≥5克)和医疗器具”为《中国药典》2010版二部附录ⅩⅠH无菌检查法项目。《中国药典》2010版三部附录ⅩⅡA无菌检查法
表1 出厂制品不同规格及原液和半成品最少抽验数量) 供试品 批产量(N);装量(V) 最少抽验数量 注射剂 N≤100 5个 100<N≤500 10个 N>500 20个 冻干血液制品 V>5ml 每柜冻干N≤200 5个 每柜冻干N>200 10个 V≤5ml N≤100 5个 100<N≤500 10个 N>500 20个 原液或半成品 每个容器取样,取样量为每个容器制品总量的0.1%或不少于10ml。每开瓶1次,应如上法抽验。体外用诊断制品半成品每批抽验量应不少于3ml。 表2液体制剂最少检验量及上市抽验样品的最少检验数量 供试品装量V(ml) 每支供试品接入每种培养基的最少量 供试品最少检验数量(瓶或支) ≤1
1<V<5
5≤V<20
20≤V<50
50≤V<100
50≤V<100(静脉给药)
100≤V≤500
V>500 全量
半量
2ml
5ml
10ml
半量
半量
500ml 10①
10
10
10
10
10
6①
6 注:①若供试品每个容器内的装量不够接种两种培养基,那么表中的最少检验数量加倍。
(注:《中国药典》2010版三部附录ⅩⅡA无菌检查法
表2上市制品监督抽验数量) 品种及装量(V) 最少抽验量 血液制品V<50ml 6个 血液制品V≥50ml 2个 其它生物制品 10个 表3固体制剂最少检验量及上市抽验样品的最少检验数量 供试品装量M/支或瓶 每支供试品接入每种培养基的最少量 供试品最少检验数量(瓶或支) M <50mg
50mg≤M<300mg
300mg≤M<5g
M≥5g
外科用敷料棉花及纱布
缝合线、一次性医用材料
带导管的一次性医疗器具
(如输液袋)
其它医疗器具 全量
半量
150 mg
500 mg
取100 mg或1cm×3cm
整个材料③
整个器具③(切碎或拆散开) 10①
10
10
10②
10
10①
10
10① 注:①若供试品每个容器内的装量不够接种两种培养基,那么表中的最少检验数量加倍。②抗生素粉针剂(≥5克)及抗生素原料药(≥5克)的最少检验数量为6瓶(支)。桶装固体原料的最少检验数量为4个包装。③如果医用器械体积过大,培养基用量可在2000ml以上,将其完全浸没。
(注:《中国药典》2010版三部附录ⅩⅡA无菌检查法
表3不同规格制品的最少接种量) 规格每支(瓶)供试品的最少接种量液体制剂(ml)V≤1 全量1<V≤5半量5<V<202ml20≤V<5010mlV≥50半量原液或半成品M <50mg半量固体制剂 M <50mg 全量50mg≤M<300mg半量300mg≤M<5g150mgM≥5g半量
这个并不是你封闭就可以的,关键是你的封闭要有文件支持,也就是验证,验证过你的干燥工段前的工序没有任何的交叉污染。
另外 你所说的GMP的厂房是洁净室还是什么?如果你所说的是洁净室 那就可以明确告诉你 没有必要,如果是无菌要求,经过验证这个进入最终干燥工段前可以达到无菌的要求就可以了。
但是如果你说的不是洁净室,比如指南规定中的要求:
0801 企业的生产环境应整洁;厂区地面、路面及运输等不应对药品生产造成污染;生产、行政、生活和辅助区总体布局应合理,不得互相妨碍。
1. 厂房周边环境情况,生产、行政、生活和辅助区的布局是否合理。
2. 化学合成、脏器组织处理及危险品库、试验动物房等的设置不得对原料药的生产造成污染。
3. 锅炉房的位置煤堆、煤渣的放置,垃圾存放,明沟处理,闲置物资堆放等不得影响原料药生产。
4. 兼有原料药及制剂生产企业,原料药生产不得对制剂生产造成污染或妨碍。
0901 厂房应按生产工艺流程及所要求的空气洁净度级别进行合理布局。
1. 工艺布局:化学合成及其他形式的前处理工序,与精、烘、包工序不得互相妨碍。
2. 厂房空气净化洁净度级别、布局应符合药品GMP中相应条款的规定。
3. 药品法定标准中列有无菌检查项目的原料药,其暴露环境应为10,000级背景下的局部100级;其他原料药的生产暴露环境不低于300,000级。
4. 无菌原料药内包装材料(直接接触药品)的最终处理环境应为10,000级;对于非最终灭菌的无菌原料药,内包装材料最终处理后的暴露环境应为100级或无菌10,000级背景下的局部100级。
这些都是必须的,无论你的生产是什么样子的,这些都是必须的。
你干燥的工段应该不是最后的吧?最后应该是包装啊。所以 把干燥和包装放置于洁净区域 其他工序符合上面的规定就可以了
还有一个问题,你的管道符合要求么?按照你的说法,你的管道在最终进入洁净区之前 内容物就已经达到最终成品了,对吧,你的设备已经直接接触产品了,你应该用到卫生级的材质做的管道,还有一个想不通的问题就是,那个你精制是在外面,既然要干燥,说明你干燥前就已经是湿品了,你湿品怎么通过管道输送?传送带?传送带肯定不行,其他的 我想不明白,如果你的产品在液体里进去,那就好说了,那你进去以后还有一个过滤或者离心的过程,这个就可以说是精制了。前面的不过是合成。
看不到工艺,不知道产品,也就只能这么分析下。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。