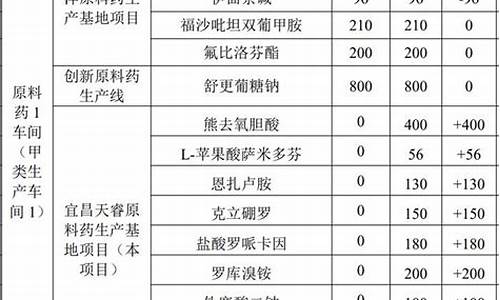
原料药生产企业应当按照核准的生产工艺组织生产-药品生产企业原料药

DMF是英文DRUG MASTER FILE的简称,译为"药品主文件,"它是反映药品生产和质量管理方面的一套完整的文件资料。主要包括生产厂简介、具体质量规格和检验方法、生产工艺和设备描述、质量控制和质量管理等方面的内容。
根据不同国家和地区对注册程序的规定和DMF的编写要求不同,DMF大致分为两种,一种是欧洲共同体国家所要求的DMF(简写为EDMF),一种是美国FDA所要求的。前一种要求重点介绍产品的工艺质量控制、杂质和稳定性研究等方面的资料和数据;后一种DMF被细分为五类,在EDMF基础上,尚需介绍生产厂的厂房、设施、人员、GMP管理、机构和职责等方面的内容。
在欧共体,DMF是办理市场销售许可证的一部分。药品要在欧共体或销售国家药品管理局申报一套资料,办理市场销售许可证。当药品所用的活性成份(即原料药)的供应商改变时,同上办理。而DMF是申报资料的重要部分。不按要求提供DMF,就不能把所生产的产品销售到该国家。
在美国,虽然FDA没在正式文件中规定出口到美国的原料厂家必须上报DMF资料,但实际上大家都在做,而且美国FDA也发表了编写DMF文件的指南。若该原料药被用做处方药的成分时,则美国FDA一定派员对生产厂家进行检查,以确定该厂的生产是否与上报资料所述相符,是否是按美国CGMP(现行GMP)要求进行。鉴于欧共体和美国对进口原料药的严格的管理,编写一份符合要求的DMF文件对促进原料药的出口是至关重要的。
我公司自20世纪90年代初组织人员对主要出口原料药编写DMF,当时主要是按美国格式编写的。这些文件对当时我公司国际贸易的开展起了重要的作用,也使大家了解了DMF文件对原料药出口的重要性。随着国际贸易的深入和GMP的不断发展,对DMF的内容不断提出了新的要求。自1996年以后,陆续对老版本的DMF进行了改版。我公司大部分的原料药销往欧美两个市场,因此要准备两个版本的DMF文件。EDMF有固定的格式,但在内容的深度和广度上不同的客户会提出不同的要求,因此,一个产品可能会有一个以上的EDMF版本。美国DMF没有固定的格式,不同的咨询官会有不同的风格,而且,咨询官为保证能一次通过FDA的审查,都比较坚持自己固有的风格。若在编写DMF的过程中更换了咨询官,所有的资料可能会从头再来。例如:氢化可的松的美国版DMF,已经由第一个咨询官逐页审核,准备呈递DMF时,由于更换咨询官,我公司不得不将厚达2寸的DMF文件按第二位咨询官的要求改版。因此,DMF的编写不会因编好了一个版本就一劳永逸了,需要按客户的要求以及工艺和设施变更的情况不断地修改补充完善,重大的变更必须通知客户。美国FDA要求,即使没有变更,每年也需要递交一份没有改变的声明。DMF在修改较多时必须要换版。
原料药与制剂药的区别?
包括。
新的生产监管办法中,上市许可持有人和受托生产企业也纳入生产许可证管理范围。从事制剂、原料药和中药饮片生产活动需要办理生产许可证。
上市许可,最先使用于药品企业新药品投入市场之前,卫生监督机构会对该药品进行的一系列审查。
采购原料药需要什么资质
原料药是批由化学合成、植物提取或着生物技术所制备的各种用来作为药用的粉末、结晶、浸膏等,但病人无法直接服用,需要进一步加工的物质。
制剂系根据药典、药品标准、制剂规范等规定的处方,加工或提取后制成具有一定规格,可以直接用于防病治病的一类药品。
药品生产企业属于国民经济行业分类与代码2016中的哪一类
1、药品经营许可证,药品经营企业必须取得药品经营许可证才可从事相关业务。
2、GMP证书,GMP是药品生产企业生产药品所必须遵守的质量管理规范,原料药生产企业也需要遵守GMP规范并获得的证书。
3、药品经营质量管理规范认证证书,药品经营企业需要根据药品经营质量管理规范进行认证,获得的认证证书。
国内有哪些提供禽药原料药的知名企业?
药品生产企业在国民经济行业中中类为 医药制造业, 针对具体生产的主要药品对照下列小类进行归类:
1、 行业代码: 2710—化学药品原料药制造 指供进一步加工化学药品制剂所需的原料药生
产活动;
2、 行业代码:2720—化学药品制剂制造 指直接用于人体疾病防治、诊断的化学药品制剂的制造 ;
3、 行业代码:2730—中药饮片加工 指对采集的天然或人工种植、养殖的动物和植
物的药材部位进行加工、炮制,使其符合中药处方调剂或中成药生产使用的活动 ;
4、 行业代码:2740—中成药生产 指直接用于人体疾病防治的传统药的加工生产
活动 ;
5、行业代码:2750—兽用药品制造 指用于动物疾病防治医药的制造;
6、行业代码:2760—生物药品制造 指利用生物技术生产生物化学药品、基因工程
药物的生产活动;
7、行业代码:2770—卫生材料及医药用品制造 指卫生材料、外科敷料、药品包装材料、辅料以及其他内、外科用医药制品的制造 。
常规药品生产企业在国民经济中行业属生物药品制造 ,行业代码2760,指利用生物技术生产生物化学药品、基因工程药物的生产活动。
原料药有自己公司注册的标准可以不执行执行国家标准么
1、中牧CAHIC ( 国内最大的动物保健品生产企业之一,农业产业化重点龙头企业,北京市高新技术企业,中牧实业股份有限公司 )
2、Zoetis硕腾 ( 由辉瑞旗下动物保健更名而来,全球最大的动物保健品提供商之一,引领动保行业,硕腾(苏州)动物保健品有限公司 )
3、Merial梅里亚 ( 源于法国的世界著名动物保健品品牌,全球动物保健行业领导者,大型跨国企业,梅里亚动物保健有限公司 )
4、勃林格殷格翰 ( 世界领先的动物保健品企业,全球最大的猪疫苗供应商之一,大型制药企业,上海勃林格殷格翰药业有限公司 )
5、拜耳BAYER ( 全球制药巨头,世界领先的兽用医药专业产品供应商之一,世界500强企业,大型跨国企业,拜耳医药保健有限公司 )
6、宝灵BAOLING ( 内蒙古著名商标,农业部定点口蹄疫疫苗骨干企业,国家级兽用疫苗工程实验室,金宇保灵生物药品有限公司 )
7、瑞普ringpu ( 天津名牌,国内规模最大/产品种类最全的动物保健品生产基地之一,行业领先企业,津瑞普生物技术股份有限公司 )
8、易邦 ( 国家保护商标,山东省名牌产品,国家级高新技术企业,兽用生物制品行业领先品牌,青岛易邦生物工程有限公司 )
9、三仪SAM ( 国家保护商标,辽宁省著名商标,领先的高科技动物药品制造商,兽用制剂知名品牌,大连三仪动物药品有限公司 )
10、远征 ( 国家保护商标,国内规模最大的兽药制剂企业之一,国家高新技术企业,知名兽药品牌,河北远征药业有限公司 )
关于原料药是否可以自己公司注册标准而不执行国家标准的问题,需要明确以下几点:
首先,药品作为一种特殊的商品,其质量直接关系到公众的健康和安全。因此,各国政府都对药品的生产、销售和使用制定了严格的法律法规和标准。在中国,药品的生产必须遵循《药品管理法》等相关法律法规以及国家药品标准。
其次,原料药作为药品的重要组成部分,其质量同样受到严格的监管。原料药的生产企业需要根据国家药品标准制定自己的生产工艺和质量标准,并经过药品监管部门的审批和备案。这些标准通常会在国家药品标准的基础上,结合企业自身的实际情况进行细化和完善。
然而,这并不意味着原料药生产企业可以完全脱离国家标准自行制定标准。国家药品标准是保障药品质量的基础性、强制性标准,所有药品生产企业都必须遵守。原料药生产企业在制定自己的标准时,必须确保不低于国家药品标准的要求,以保证原料药的质量和安全性。
此外,值得注意的是,随着全球化和国际贸易的发展,许多原料药都用于出口。在这种情况下,原料药生产企业还需要关注国际药品标准,如ICH(国际人用药品注册技术协调会)标准等,以确保产品符合进口国的质量要求。
综上所述,原料药生产企业可以根据自身实际情况制定高于国家标准的生产工艺和质量标准,但绝不能低于国家标准。同时,在参与国际贸易时,还需要关注并符合国际药品标准的要求。
以上内容是由猪八戒网精心整理,希望对您有所帮助。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。