原料药的特点-原料药的原料主要有哪些

原料药的质量是药品质量的基础,其质量不能仅依靠最终的质量标准来控制和保证,还必须对整个制备过程加以控制。结合目前原料药的审报情况,分析整理出以下问题,提请申报者关注:(一)合成工艺 1、缺乏对合成用起始原料、关键原料的合理控制。起始原料内控标准的制订不仅仅是研究资料完整性的一个方面,更重要的是有利于申报单位加强对原料药合成的 起点控制,最大限度地降低可能引入的杂质,保证终产品的纯度。审评中发现申报资料部分研究单位往往忽视制订起始原料的内控标准,或者即使制定,也不是结合 起始原料的工艺设定合理的质控项目(比如未结合工艺,制定相应的杂质控制以及残留溶剂控制)。2、缺少反应终点的监测方法与中间体质控方法。对于反应终点的监测以及中间体的控制,是构成产品质量控制体系的一部分重要内容。建议研发者尽量采用TLC等方法监测反应进程,对关键中间体应建立HPLC法等定量分析方法进行质控,以保证工艺与质量的稳。尤其需要强调的是目前手性原料的合成中,对引入手性的原料、中间体的控制过于粗略。研究单位多采用比旋度的方法对手性原料药合成中的关键原料及中间体进行 光学活性控制,但比旋度对光学纯度的质控而言,是个较为粗略的指标,其数值受样品的化学纯度、水分等的影响而会产生较大的波动,无法较准确体现样品的光学 纯度。同时,由于手物尤其是多个手性中心的药物空间结构确证以及质量控制仅依靠终点控制有一定难度,通常尚需结合起始材料以及中间体的情况进行判断, 故建议此类药物合成中采用手性HPLC法、毛细管电泳等更具专属性的方法控制相关样品的光学纯度。(二)、结构确证 1、结构确证中的对照品问题:结构确证不一定都要使用对照品,在没有对照品时,只需根据结构确证的一般原则:在全面分析化合物结构特征的基础上,结合制备 工艺、文献数据等已有的研究信息,选择针对性强的分析方法来确证化合物的结构。如果选用对照品,则需关注对照品选择的合理性:如以自研产品精制后样品作为 对照品,对结构确证而言,无专属性及特异性意义,因此并不适宜作为结构确证时的对照品;以上市制剂中提取、精制的原料为对照品,可作为部分结构确证时使 用,但由于提取、精制用溶剂及方法的差异,此类对照品与样品有可能存在晶型等方面的差异,故不适宜作为DSC、TG、粉末X-射线衍射等测定时的对照品。2、对口服固体制剂所用的难溶性原料药,缺少对样品晶型的研究晶型不同,可能会影响到产品的稳定性以及溶解性(最终影响生物利用度),为减少临床研究 的风险,建议对难溶物加强晶型研究。可采用不同的精制方法获取具有潜在晶型差异的样品,并对这些样品进行IR或粉末X-射线衍射测定以确定样品是否具 有多晶型,对具有多晶型的样品尽可能选择成熟路线制备晶型热力学稳定的样品作为制剂的原料,同时应兼顾不同晶型样品的溶解度。(三)质量研究与质量标准 该部分研究是存在问题最多的部分,最突出的是有关物质、残留溶剂方法建立的合理性、可操作性及质量可控性。1、有关物质检查:有关物质检查,包括对产品中残留合成原料、中间体、副产物及可能的降解产物的检查,是控制药品质量的重要指标,同时也是药品稳定性评价中需重点考察的项目。其方法学研究需关注以下几个项目:(1)有关物质检查波长的选择:当采用HPLC法,检测器为紫外检测器时,检测波长选择是否合理直接影响到杂质种类、数量的检出,因此检测波长的选择是 方法学研究的重要内容。审评中常见的问题包括: 直接或间接地以主成分的最大吸收波长作为检测波长,由于有关物质检查的对象是杂质,若将主药的最大吸收波长确定为检测波长,则杂质在此波长下的吸收可能偏 低,某些杂质甚至无吸收,这样会造成对杂质含量的低估甚至漏检,从而不能反映产品的真实质量。以样品进行破坏性试验(酸、碱、热、光照、氧化等)后的溶液 做紫外扫描,将扫描图谱中最大吸收波长确定为有关物质的检测波长。因破坏性试验后溶液中存在尚未破坏的主药、降解产物、辅料等,此溶液的紫外吸收为各成分 紫外吸收的加和,并不能反映降解产物的紫外吸收特性。由于未破坏主药所占比例较大,故破坏性试验后溶液的最大吸收波长一般仍为主药的最大吸收波长。因此在有关物质检查的波长选择时,首推通过二极管阵列检测器考察合成用原料、各中间体、各降解产物、主药的紫外吸收特征,或至少通过紫外扫描的方法考 证上述各样品的紫外吸收特征,选择杂质与原料相近的响应值处的波长为有关物质检查波长。对于响应值相差较大的杂质,应建立相应的检查方法及检测波长,或采 用加校正因子的自身对照法。(2)流动相筛选及方法学验证:从目前原料药的审报情况来看,在流动相筛选及方法学验证中,采用强力破坏以获得各种降解产物,并考查各降解产物与主药的分 离度的方法已被申报单位接受并认同,易被申报单位忽视的是对合成用原料、中间体与主药间分离度的考证。而对于原料药而言,这恰恰是原料药流动相筛选及考证 的重点,尤其是对于已有国家标准的原料药,验证国家标准终收载的有关物质检查方法是否适合自研产品的检验,由于合成工艺的可能不同,需重点验证合成用起始 原料、中间体同主药的分离情况。2、残留溶剂:原料药中的残留溶剂系指在原料药生产中使用,但在工艺过程中未能完全去除的有机溶剂。申报情况反映对于残留溶剂的检查可能存在以下问题:(1)研究内容不全面:未进行或只进行部分残留溶剂的检测,原料药中残留的有机溶剂特别是二类以上溶剂可能会对药物的安全性产生重大影响,其研究的重要性 不言而喻,由于历史原因,部分国家标准未制定有机溶剂检查项,但随着药检技术的发展和对残留溶剂认识的提高,残留溶剂研究成为必要的研究项目,需根据考察 结果(尤其是大生产样品的检验结果)确定是否应将该项检查定入质量标准。对制剂过程中使用的有机溶剂也建议考察其残留情况,特别是脂质体、缓、控释微丸包 衣过程使用的有机溶剂更应引起注意。一般情况下一类溶剂应禁止使用,如要使用,必须首先进行替代试验,证明在合成工艺中无法用其他溶剂替代。一类不论是在 起先还是后续的反应中使用,均应在产品中检测控制。(2)方法学研究不完整:采用GC顶空法进行测定时,研究过程中往往忽视两个非常重要的参数:顶空的平衡温度和平衡时间。平衡温度影响分配系数,并与平衡 时间相关,略高的平衡温度可以缩短平衡时间。平衡时间本质上取决于被测组分分子从样品基质到气相的扩散速度,由于样品的性质千差万别,因此平衡时间难以预 测,需通过一定平衡温度下的试验确定,以保证样品中有机溶剂的充分释出。通过研究确定合理的平衡温度与平衡时间保是保证顶空法测定残留溶剂结果可靠性的重 要前提。(3)检测器选择不当:气相的检测器用于残留溶剂的测定时最常用的是火焰离子化检测器(FID)、热导检测器(TCD)、电子捕获检测器(ECD)。申报 资料中存在的主要问题是忽视研究对象的结构特征,不加研究及选择地使用某一种检测器,如被研究对象是三氯甲烷、四氯化碳等仅含一个活泼氢或不含活泼氢的化 合物,却采用了FID检测器,导致测定结果的不可靠。(四)稳定性考察1、考察项目设置不合理:稳定性研究的考察项目应选择在药品保存期间易于变化,并可能会影响到药品的质量、安全性和有效性的项目,以便客观、全面地反映药 品的稳定性。根据药品特点和质量控制的要求,尽量选取能灵敏反映药品稳定性的指标。目前申报情况反映,有些申报单位易忽视产品的特点,仅以常规或专属性较 差的考察项目代替样品个性的考察,如对手物不考察光学异构体的变化或仅以比旋度进行粗略考察,对于易吸湿的药物不进行水分或干燥失重检查,无法全面、 真实反映样品的稳定性。2、稳定性研究中采用的方法与质量标准的方法不一致。质量标准中的方法是研究者在研发中,经过比较,认为相对合理的、可控制产品质量的方法,因此,两部分 研究中方法应尽量保持一致,以加强对结果的判断。如产品在研发过程中,质控方法进行了修订,需要分析方法变更前后对检验结果的影响。徐州宏鑫医药化工有限公司位于风景秀丽的徐州工业园区,园区地理位置优越,交通便利。
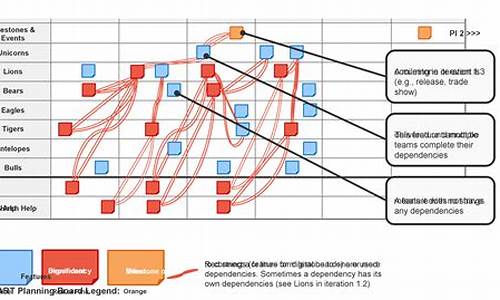
一张思维导图,看遍医药细分行业
注射用原料药:需要在万级车间生产
口服原料药:需要在10万级车间生产
一般原料药:需要在30万级车间生产
这是根据药品企业洁净室(区)的特点,针对不同情况制订的标准。
原料药中的基因毒性杂质在制剂中控不控制
看完了以银行、券商和保险为代表的大金融行业之后,我们接下来学习大消费行业中最重要的代表之一医药行业。
随着我国人口老龄化程度的不断加深,医药行业的未来发展有着坚实的群众基础。如果翻看医药行业的上市公司,可以发现在过去的十年中牛股辈出,出现了很多十倍股,给长期投资者以丰厚的回报。就冲这一点,就值得我们好好花上些时间,来学习一下如何投资医药行业。
有趣的是,除了高度的专业性之外,医药行业虽然被称为行业,其实它并不是一个业务和财务逻辑一致的行业,而是由完全不同逻辑的多个细分行业所组成的大集合。所以,我们“零基础学医药”这个系列的第一篇,就先来仔细梳理一下,医药行业到底有多少个细分子行业,并对它们一一加以简要介绍。
医药行业的细分,首先从医药分家开始。
说到医疗,大家首先会想到医院。医院是什么地方呢?是医生给病人看病的地方。医生做什么呢?为患者提供医疗服务。所以,从医的角度来讲,医药行业的第一个细分子行业就是 医疗服务 。
在A股的上市公司中,代表性的医疗服务企业是爱尔眼科。爱尔眼科是专业眼科连锁医疗机构,截至2019年,已在中国大陆30个省市区建立270余家专业眼科医院,覆盖全国医保人口超过70%,年门诊量超过650 万人。并且,在美国、欧洲和香港开设有80余家眼科医院。
从事 健康 体检业务的美年 健康 ,是医疗服务领域另一家代表性的企业。美年 健康 是一家以 健康 体检为核心,集 健康 咨询、 健康 评估、 健康 干预于一体的专业体检和医疗服务集团。公司总部位于上海,深耕布局北京、深圳、沈阳、广州、成都、武汉、西安、天津、重庆、杭州等200余个核心城市,布局400余家医疗及体检中心,专业服务团队拥有全职专家、医护及管理团队40000余人。2017年已为2000万人次提供专业 健康 服务,2018年体检人次预计将突破3000万大关,是医疗和大 健康 板块中市值和影响力杰出的上市公司。
此外,一些上市公司参控股民营医院,这部分业务也属于医疗服务。代表性的有复星医药投资的禅城医院,2018年初,禅城医院高分通过国际医院JCI认证,成为全国首家通过第六版JCI标准的三甲综合医院。
医疗服务行业,是一个非常好的行业,因为人总要生病,生病就需要去医院看病,由医生来提供医疗服务;而 健康 的人,也需要定期体检,来及早发现潜在隐患。这些都是刚性需求,几乎不受经济周期波动的影响。从供给的角度来看,专业的医生需要长期的学习与实践才能养成,其能提供的服务数量总体有限,因而医疗服务行业的价格长期来看都是不断增长的,能够有效战胜通胀。
说完了医,我们再来看看药。
我们这里的医药制造,是一个广义的概念,包括了医药的研发、生产和制造。首先,医药企业需要通过研发,来发现和创造一个新的药物,这就是创新药的概念,侧重点在研发。其次,一个新的药物通过医药企业研发出来,并通过了国家食药监局的审批之后,就可以大规模生产制造,准备上市了,这个环节的关键点在于生产。所以,广义的医药制造,其关键切分点就在于是否需要做创新药的研发。
创新药
如果一家药企,主要的精力放在研发上,以发现新的药物为主,那这家企业就是 创新药 企业。国际上,著名的医药企业都是创新药企业,比如辉瑞(Pfizer)、诺华(Novartis)、罗氏(Roche)、默克(Merck)、赛诺菲(Sanofi)、强生(Johnson & Johnson)、吉利德(Gilead Sciences)、葛兰素史克(GlaxoSmithKline)、艾伯维(AbbVie)、安进(Amgen)等。
在A股市场上,最著名的代表性创新药企就是恒瑞医药,也是目前市值最高的医药企业,最新市值高达2500亿元。恒瑞医药是一家从事医药创新和高品质药品研发、生产及推广的医药 健康 企业。截至2018年底,共有全球员工20000余人,是国内知名的抗肿瘤药、手术用药和造影剂的供应商,也是国家抗肿瘤药技术创新产学研联盟牵头单位,建有国家靶向药物工程技术研究中心、博士后科研工作站。
创新药企业,都有着高比例的研发投入。以恒瑞医药为例,公司 每年投入销售额10%以上 的研发资金,在美国、欧洲、日本和中国多地建有研发中心或分支机构。截至2018年底,公司的研发团队已有3000多人,其中包括2000多名博士、硕士及100多名海归人士。公司累计申请国内发明专利655项,拥有国内有效授权发明专利147项,欧美日等国外授权专利226项,专有核心技术获得国家 科技 进步二等奖2项,中国专利金奖1项。
仿制药
如果一家药企,主要的精力不是放在原创性的研发上,而是对于那些专利保护到期的药品进行仿制生产,那么这家企业就是 仿制药 企业。
仿制药的意义在于,其不需要高昂的研发投入,也不需要重复进行创新药批准之前所必须的多年临床前动物研究和人体临床研究,因而其生产成本要显著低于创新药。为了确保仿制药可以治病,仿制药需要与被仿药具有相同的活性成分、剂型、给药途径和治疗作用,即需要证明和原创药具有相同的生物等效性。
在我们国家,食药监局通过 一致性评价 ,来监管仿制药的疗效。只有那些通过仿制药一致性评价的药企,才能够销售该仿制药,并参与医保药品的竞标。所以, 通过一致性评价的仿制药数量 ,通常是考察一家仿制药企的研发实力的量化指标。
在A股市场上,代表性的仿制药企业有华东医药。公司主要从事抗生素、中成药、化学合成药、基因工程药品的生产销售,以及中西药、中药材、医疗器械等的批零经销业务,是一家集医药研发、制药工业、药品分销、零售、医药物流为一体的大型综合性医药上市公司。华东医药主要通过子公司中美华东来完成仿制药的生产,其2017年销售额超60亿元,是国内器官移植和糖尿病药物研发和生产领域领导企业。华东医药,是一家很有特点的企业,这从它的企业经营战略口号中可以窥见一斑:“ 不求品种很多,但求产品最大;要么唯一,要么第一;不一定要做火车头,但一定要乘上第一节车厢 ”。
除了以是否做原创品研发来分类之外,医药制造企业还可以按照药物的属性分为:
其中,化学药企还可以进一步细分为:
下面,我们分别介绍按照药物属性分类的各类药企。
原料药
原料药的英文简称为API(Active Pharmaceutical Ingredient),其是指用于药品制造中的任何一种物质或物质的混合物,而且在用于制药时,成为药品的一种活性成分。
具体来说,原料药企业又分为两个大类:
在A股市场中,代表性的大宗原料药企业是中小企业板第一股(002001)新和成。公司是一家主要从事营养品、香精香料、高分子新材料和原料药的生产和销售的国家级高新技术企业。公司是世界四大维生素生产企业之一、全国大型的香精香料生产企业和维生素类饲料添加剂企业。
特色原料药的代表性企业是华海药业。公司是中国首家通过美国FDA制剂质量认证并自主拥有ANDA文号的制药公司,也是首家在美国实现规模化制剂销售的中国制药公司。公司现有员工6500多人,在全球拥有40多家分子公司(包括美国、日本、德国、俄罗斯、西班牙、印度等);主要业务覆盖化学药、生物药、医药包装、贸易流通等多个领域,与全球500多家制药企业建立了长期合作关系,为近200个国家和地区提供医疗 健康 产品,是全球主要的心血管、精神类 健康 医疗产品制造商之一。
大宗原料药,由于其类似大宗商品,使得其生产企业具有典型的 周期属性 。从投资的角度来看,比较像化工企业,行业低谷(低PB高PE)的时候买入,行业高峰(高PB低PE)的时候卖出。
特色原料药,主要是给下游的制剂企业、成品药企做配套,从而有着类似“ 苹果产业链 ”的特点。从投资的角度来看,主要看这家企业的下游客户是谁,如果前十大客户都是国际上著名的制药企业,那这家公司的实力就是不错的;如果前十大客户都是较少的制药企业,可能在投资上就需要谨慎一些。
化学制剂
药物制剂,通俗来说,就是将原料药和其他辅料(比如医用胶囊)加工成成品药物。在化学制剂这个领域,大部分药企都是仿制药企业。
在A股中,化学制剂企业还是比较多的,除了上文“仿制药”一节提到的华东医药之外,代表性的上市公司还有丽珠集团、信立泰、恩华药业等。
从投资的角度来看,主要考虑以下几点:
中成药
中成药是我们国家的一个特色,有着 历史 悠久的传统中医作为广泛的群众基础。按照是否需要医生开处方,中成药可以分为:
在A股市场中,代表性的中成药企业云南白药、同仁堂、东阿阿胶、片仔癀、天士力等。此外,中药饮片的代表性企业是康美药业。
生物药
生物药物是指运用生物学、医学、生物化学等的研究成果,综合利用物理学、化学、生物化学、生物技术和药学等学科的原理和方法,利用生物体、生物组织、细胞、体液等制造的一类用于预防、治疗和诊断的制品。
通俗来说,生物药企业就是基于生物体来制造药物的企业。生物药有着众多的细分品类,包括:
在A股市场中,代表性的血制品企业是华兰生物。公司是一家从事血液制品、疫苗、基因工程产品研发、生产和销售的国家高新技术企业。也是我国血液制品行业中血浆综合利用率最高,品种最多、规格最全的企业之一。
代表性的疫苗企业有智飞生物、沃森生物和康泰生物,当然还包括疫苗事件的主角长生生物。其中,智飞生物是国内综合实力最强的上市民营生物疫苗供应和服务商之一。
代表性的重组蛋白药物企业是长春高新,主要的产品是重组人生长激素(辅助生长)和注射用重组人促卵泡激素(辅助生殖)。此外,还有生产重组人胰岛素的通化东宝,该公司使得中国成为继美国、丹麦之后的第三个能生产重组人胰岛素的国家。
代表性的单抗企业有复星医药旗下的复宏汉霖、信达生物制药、齐鲁制药等。
看完了医药制造之后,我们再来看看医药行业里面的另一个大的细分领域:医疗器械。与药品类似,医疗器械也是五花八门。
首先,我们来看看 制药装备 ,这是每一家药企所必需的。代表性的A股上市公司有东富龙和楚天 科技 。东富龙是一家为全球制药企业提供制药工艺、核心装备、系统工程整体解决方案的综合性制药装备服务商,是国内最大的冻干机设备制造商。楚天 科技 主营业务为水剂类制药装备的研发、设计、生产、销售和服务,是我国替代进口制药装备产品的代表企业。
制药装备,类似于基建领域的挖掘机,代表了下游药企GMP车间改造的需求,因而局部明显的 行业周期性 。当下游GMP改造需求大幅增长的时候,上游制药装备企业的订单就会放量增长,带来营业收入和净利润的明显增长;当下游GMP改造需求减弱时,订单就会大幅减少,营收和净利润就会显著下滑。
其次,我们来看看 高端医疗器械 ,比如常见的冠脉支架以及骨科的医疗器械。这些品种,往往单价都很高,终端价格甚至过万元,出厂价差不多是终端价格的三折(三零扣),体现了产品的高单价、高毛利特点。与此同时,三类医疗器械从开始进入临床,到最后获批可能需要五年甚至更长的时间,研发投入不菲,研发周期也较长,这一点和 创新药 类似。
在A股中,代表性的高端医疗器械公司是乐普医疗,公司是国内领先的心血管病植介入诊疗器械与设备的高端医疗产品产业集团,拥有国家 科技 部授予的国家唯一的国家心脏病植介入诊疗器械及装备工程技术研究中心,是国内高端医疗器械领域能够与国外产品形成强有力竞争的少数企业。乐普医疗的核心产品就是心脏支架,其产品研发也经过多次迭代,从最早的Partner系列,到Nano系列,再到正在申报的完全可降解的NeoVas系列,不断进行产品的研发升级。
最后,我们来看看医疗器械领域的大众消费品: 家用医疗器械 。常见的家用医疗器械包括血压计、制氧机、呼吸机、血糖仪、轮椅、拐杖等,这些产品和 非处方药 类似,偏消费属性,通常在药店购买。
在A股中,代表性的家用医疗器械公司是鱼跃医疗。鱼跃医疗是一家以提供家用医疗器械、医用临床器械和互联网医疗服务为主要业务的公司,产品主要集中在呼吸供氧、康复护理、医疗急救、手术器械、中医器械、护理类耗材、药用贴膏及高分子卫生辅料及提供医院消毒感染控制解决方案等领域。公司已成为了国内医疗器械行业领先企业,是国内最大的康复护理和医用供氧系列医械厂商。
与药品相比,医疗器械领域的天花板要低很多。在药品中,一个大的单品可以有几十亿甚至超过一百亿的年销售额,而医疗器械很难找到这样的单品。同时,在一个子领域取得成功的产品,通常不能将其成功经验复制到另一个子领域。这两个特点,使得医疗器械领域主要依靠外延式并购来扩大企业规模,这一点在国内最大的医疗器械上市企业迈瑞医疗的发展壮大过程中得到了充分的体现。
迈瑞医疗是中国最大、全球领先的医疗器械及解决方案供应商,产品覆盖生命信息与支持、体外诊断、医学影像三大主要领域。公司在中国超过 30 个省市自治区设有分公司,境外拥有 39 家子公司。全球员工近万人,其中研发人员占比超过 20%,外籍员工超过 10%,来自全球 30 多个国家及地区,形成了庞大的全球研发、营销和服务网络。
最后,我们再来看看医药商业。医药商业主要有两种业态(商业模式):
国资背景企业在医药商业市场占绝对主导地位,全国排名前三的医药商业企业均为国资背景,分别是国药控股(港股)、华润医药(港股)和上海医药(A股)。一些地方性医药商业企业龙头同样有国资背景,如南京医药、华东医药、重庆医药、柳州医药、人民同泰等。
在A股种,医药零售的代表性企业是益丰药房。公司是国内领先的药品零售连锁企业之一,主要从事药品、保健品、医疗器械以及与 健康 相关的日用便利品等的连锁零售业务。截止2018年6月30日,公司在湖南、湖北、上海、江苏、浙江、江西、广东七省共开设了2,499家连锁门店,向顾客销售药品、医疗器械、保健品、 健康 食品、个人护理用品及与 健康 相关的日用便利品等商品。
从投资角度来看,医药零售主要是连锁药店模式,行业的发展主要依靠两个要素:一个是连锁药店的门店数量,通过自营、加盟以及并购的方式进行扩张;另一个是单店的经营效率,通过坪效、人均利润等指标考量。此外,随着处方药的逐步外流,考虑到处方药是一个万亿级别的大市场,而零售药目前还在三四千亿的水平,未来医药零售行业还有比较大的处方外流的空间。
由于医药行业的多元性,我们在这一篇中对其进行系统性梳理,将细分行业主要归结为四个方面,分别是医疗服务(医)、医药制造(药)、医疗器械(器械)和医药商业(流通)。
所有这些,我们通过如下的思维导图加以概括,方便读者阅读。
为什么养殖场不能直接使用原料药
原料药中的基因毒性杂质在制剂中控不控制
1什么是基因毒性杂质
基因毒性杂质(或遗传毒性杂质,Genotoxic Impurity ,GTI)是指化合物本身直接或间接损伤细胞DNA,产生基因突变或体内诱变,具有致癌可能或者倾向。潜在基因毒性的杂质(Potential Genotoxic Impurity ,PGI)从结构上看类似基因毒性杂质,有警示性,但未经实验证明的黄曲霉素类、亚硝胺化合物、甲基磺酸酯等化合物均为常见的基因毒性杂质,许多化疗药物也具有一定的基因毒性,它们的不良反应是由化疗药物对正常细胞的基因毒性所致,如顺铂、卡铂、氟尿嘧啶等。
2为何着重研究基因毒性杂质
基因毒性物质特点是在很低浓度时即可造成人体遗传物质的损伤,进而导致基因突变并可能促使肿瘤发生。因其毒性较强,对用药的安全性产生了强烈的威胁,近年来也越来越多的出现因为在已上市药品中发现痕量的基因毒性杂质残留而发生大范围的医疗事故,被FDA强行召回的案例,给药厂造成了巨大的经济损失。例如某知名国际制药巨头在欧洲市场推出的HIV蛋白酶抑制剂维拉赛特锭(Viracept, mesylate),2007 年7月,EMA暂停了它在欧洲的所有市场活动,因为在其产品中发现甲基磺酸乙酯超标,甲基磺酸乙酯是一种经典的基因毒性杂质,该企业为此付出了巨大的代价,先内部调查残留超标的原因,因在仪器设备清洗时乙醇未被完全清除而残留下来,与甲基磺酸反应形成甲基磺酸乙酯。在被要求解决污染问题后还被要求做毒性研究,以更好的评估对患者的风险。同时有多达25000 名患者暴露于这个已知的遗传毒性。直到解决了这所有问题后 EMA才恢复了它在欧洲的市场授权。
近年来各国的法规机构如ICH、FDA、EMA等都对基因毒性杂质有了更明确的要求,越来越多的药企在新药研发过程中就着重关注基因毒性杂质的控制和检测。
3哪些化合物是基因毒性杂质
杂质的结构多种多样,对于绝大多数的杂质而言,往往没有充分的毒性或致癌研究数据,因而难以对其进行归类。在缺乏安全性数据支持的情况下,这些法规和指导原则采用“警示结构”作为区分普通杂质和基因毒性杂质的标志。对于含有警示结构的杂质,应当进行(Q)SAR预测和体内外遗传毒性和致癌性研究,或者将杂质水平控制在毒理学关注阈(TTC)之下。
目前,一般将致癌物分成两大类:一类是遗传毒性致癌物,通过化学键合直接破坏遗传物质产生致癌性, 大多数的化学致癌物具有遗传毒性; 第二类是非遗传毒性致癌物, 通常不与发生化学键合作用, 不对产生直接破坏, 而是通过遗传物质外的间接机制引起致癌作用( 如促进细胞过度增殖等)。
将多个文献中的警示结构汇总于(见原文PDF)。关于基因杂质警示结果的具体详细信息另外可参考欧盟发布的警示结构《Development of structure alerts for the in vivo micronucleus assay in rodents》。或进入 The Carcinogenic Potency Database (CPDB),里面有 1547 种致癌物质的列表,结构式,CAS 号,作用部位,TTC 值等一系列信息。应当注意, 含有警示结构并不意味着该杂质一定具有遗传毒性, 而确认有遗传毒性的物质也不一定会产生致癌作用。杂质的理化性质和其他结构特点(如相对分子质量、亲水性、分子对称性 / 空间位阻、反应活性以及生物代谢速率等)会对其毒性产生抑制或调节作用。警示结构的重要性在于它提示了可能存在的遗传毒性和致癌性, 为进一步的杂质安全性评价和控制策略的选择指明方向。
4对基因毒性杂质的法规要求及限度
最初,ICH相继推出的原料药杂质研究指导原则Q3A(R2)、制剂杂质研究指导原则 Q3B(R2),在这些指导原则中提及“对于能够产生强的药理活性或毒性的潜在杂质,即使其含量低于0.1%,仍然建议进行结构鉴定研究”。在之后的修订版中,还进一步明确“要关注原料药中的潜在遗传毒性杂质”,以及“对于毒性非常强的杂质,可能需要制定更低的限度”,但是其中并未明确阐述遗传毒性杂质的研究和控制问题,也未提出具体的研究原则、控制策略和限度要求。
在EMA(欧洲药物评审组织)推出《遗传毒性杂质限度指导原则》, 引入了可接受风险的摄入量,即毒性物质限量,或称毒理学关注门槛(TTC,Threshold of Toxicological Concern)这个概念。设置了限度值 TTC(1.5 μg/day),即相当于每天摄入1.5 μg的基因毒性杂质,被认为对于大多数药品来说是可以接受的风险(一生中致癌的风险小于十万分之一)。按照这个阈值,可以根据预期的每日摄入量计算出活物中可接受的杂质水平。需要指出的是TTC是一个风险管理工具,它采用的是概率的方法。假如有一个基因毒性杂质,并且我们对它的毒性大小不太了解,如果它的每日摄
为了达到预防、控制畜禽群疾病目的,有时需要在畜禽饲料或饮水中添加兽药。生产实践中,某些养殖场常常直接使用兽药原料药,一些大型养殖场也有这方面的违法投药。养殖户自认为,使用原粉,操作方便省事,且投药量小,成本相对低,能有效降动保费用。其实,直接使用兽药原粉的弊远大于这点“蝇头小利”!
一、法规规定“饲料或饮水中添加兽药原料药违法”
发布的《兽药管理条例(2004)》 第四十一条明确规定:“批准可以在饲料中添加的兽药,应当由兽药生产企业制成药物饲料添加剂后方可添加。禁止将原料药直接添加到饲料及动物饮用水中或者直饲喂动物。”第六十八条规定:“上述行为处1万至3万元罚款。给他人造成损失的,依法承担赔偿责任。”
二、兽药原料药与相应药物剂型其药效-药代等参数已有很大差异
绝大部分原料药都是在附型剂(增效剂、助溶剂、稳定剂等多种成分)等作用下经各类工艺加工制得临床所需剂型,这些制剂类型优化了其药效-药代动力学特征,如改善其溶解性、或提高其抑杀菌活性、或增加其稳定性、或延长有效血药浓度时间、或提高生物利用度、或具备缓释功能、或选择酸性(或碱性)环境发挥药效等。现制定的各养殖场药物给药方案都以较优制剂类型为标本,其给药方式、剂量以及药物含量都已确定,如果原料药直接给药,给药剂量不易掌握,易造成中毒以及副作用,如鸡抗球虫药马杜霉素广谱高效、养殖投药剂量低,剂型以1%剂型为主,但该药安全范围(描述治疗剂量与中毒剂量差距)窄,因此直接原粉给药极易造成中毒;此外即使原料药添加剂量大也不能达到治疗效果,如氟苯尼考水中极微溶,饮水中大剂量添加原粉,其药效欠佳;阿莫西林原粉直接添加其药效肯定比不过阿莫西林克拉维酸钾复方剂型抑杀菌效果。
三、原料药用量极低,易出现拌料不均匀,从而达不到药物均匀投送,群防效果差
混合不均匀会造成某些畜禽摄入过高剂量而造成药物浪费或是中毒,其他畜禽摄入药物几乎无法达到最小有效剂量而不能建立保护措施。而制成药物含量不等的预混剂、可溶性粉后,其添加量大,更易混合均匀达到整体均匀给药的目的。
四、原料药大部分适口性差、异味、刺激性强,畜禽摄入“愿望”不强
由于原料药该方面的缺点造成畜禽摄入“动力”不足,故很难达到药物有效剂量,因此制成相应剂型便可掩盖苦味等异味、降低口腔摄入、注射部位不适感、让其相对“柔和”。
五、原料药的药物联用和配伍禁忌依据无资料支撑,难以做出指导
经典配伍禁忌是以各常用临床剂型为选择对象得出的药物联用组合,而某些原料药与剂型理化性质以及药代特点有较大差异,因此原料药的药物联用效果不好把握,如产生配伍禁忌轻则对疾病治疗失效,重则造成中毒现象,危害畜禽安全!总之,于法于理都不建议在养殖场使用兽药原粉!
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。