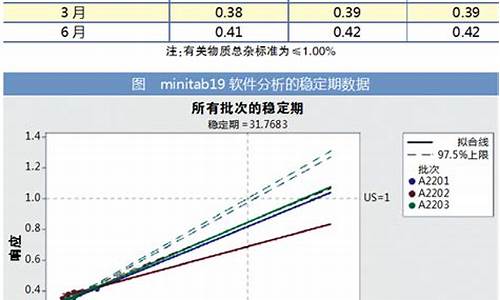
原料药溶剂-原料药溶剂残留限度

相信许多得了传腹的家长,都会被441昂贵的价格所头痛,一些具备配置441的家长也想过自己配置药物,但是不知道具体如何配置,我也是从治疗传腹一路走过来的,经历了许多弯路,所以在这里分享给大家治疗传腹441药物的溶剂配方和溶解注意事项:
原料药尽量从正规渠道购买。其实国内山寨水平已经很高了,正版441药物确实价格很贵,达到了1000元/g左右,但是山寨的价格200-500元之间,而且纯度还很高,因为国内具备这个只要水平,只是没专利而已。
盐酸的作用:由于药物的盐酸盐往往是各种盐中溶解度很高的,氯离子往往完全没有毒性(释放速度太快当然也是会超过中毒剂量的,所以其实也不是越高越快越好的),因此常常被选中,特别针对于溶解度低的药物。成盐后还能改变药物分子的微环境,使得药物溶出改变。但成盐后远没有只是简单提高溶解度那么简单,成盐后溶解过程复杂了许多,并且你也不知道到底哪个盐的溶解度最高,生物活性最高(预测各种盐的溶解度差异还是很难的)。
根据Pedersen博士的原始现场试验推荐的治疗方法是每天至少皮射12周。
应在12周结束时检查血液检查情况,并评估猫的症状,以查看是否需要进一步治疗。但是一般兽医和家长都会根据生化指标-白球比达到0.6以上就会停止治疗。具体治疗周期要结合临床情况来看个人建议,有经济能力的尽可能治疗久一点,尤其是针对干性传腹,入脑,入神经的,一定要严格达到治疗时间直到痊愈,否则再复发的时候很难救回来(因为我家猫咪就是干性二次复发,我足足治疗了100天之久,到现在还有后遗症)
猫咪注射用量:
一般是kg/0.6-0.8ml,针对不同浓度可酌情增加或者递减,也可以针对猫咪发病情况酌情增减,干性传腹入脑入神经严重的建议最大剂量治疗。
441存放:
建议现配现用,如果可能将制作完成的注射瓶120度高温灭菌,防止污染。但是配置好以后一般低温存放也没问题,存放几个月还是可以用的,只要无沉淀,结晶都可以用,但是一定要低温存放,家用冰箱请冷冻保存(不会冻结),用的时候再提前拿出来
以下是溶剂配方
配置注意事项:
1.严格保证无菌操作
2.第一次请先做预实验,配置少量药物,建议从低浓度开始配置,一般是15mg/ml,熟练后可增加浓度
3.药物难溶解问题:可滴加盐酸助溶(建议浓盐酸),也可以加DMSO(5%以内),或者增加乙醇,配置高浓度药物时如果溶解不了请逐渐滴加这些溶液(这些溶液对猫咪身体都有毒害,能少就少,尤其盐酸和乙醇很痛),实在溶不了就降低浓度,15mg/ml的也完全够用了。
4.溶液颜色问题:有人说溶液颜色不是澄清透明的就不可以用,这种观点也是有错误的,有时候溶液配置出来就是发黄,可能是配置时候温度高,也可能滴加盐酸在溶液中生成次氯酸就会变成**,只要溶液澄清无杂质就可以用,除非你的溶液是特殊异常的颜色。
5.以上所有溶液建议使用药用辅料,不要用分析纯,药用辅料安全性更高,对猫咪副作用小
6.以上溶液都具有一定危险性,请严格按照实验室规范操作,尤其浓盐酸(也可以用稀盐酸),做好保护措施。
原料药的简易方法学验证
原料药生产对空气的危害有挥发性有机物(VOCs)排放、氮氧化物排放。
1、挥发性有机物(VOCs)排放:在原料药生产过程中,会产生一些挥发性有机物,例如溶剂、溶剂蒸汽和废气。这些挥发性有机物对空气质量产生负面影响,尤其是在没有适当控制和处理的情况下。
2、氮氧化物排放:某些原料药生产过程中涉及使用氮气和氮氧化物。氮氧化物是大气污染物之一,对空气质量和人体健康有害。
医药原料药申报中易出现的几点问题
原料药:有关物质、含量、残留溶剂方法学认证。
实验也就是:系统适用性、专属性、进样精密度、线性、检测限、定量限、溶液稳定性、精密度(重复性、中间精密度、回收率)、耐用性试验,
具体操作见《中国药典》2010年版二部,附录XIX A药品质量标准分析方法验证指导原则
这一套东西就是这些,没办法简易。也就是含量和有关物质是同一个方法,然后考察的时候线性、检测限、定量限、溶液稳定性、耐用性做一套实验。别的都是药典要求的,不可能省略。
甲基异丁基酮药品有机残留几类溶剂
原料药的质量是药品质量的基础,其质量不能仅依靠最终的质量标准来控制和保证,还必须对整个制备过程加以控制。结合目前原料药的审报情况,分析整理出以下问题,提请申报者关注:(一)合成工艺 1、缺乏对合成用起始原料、关键原料的合理控制。起始原料内控标准的制订不仅仅是研究资料完整性的一个方面,更重要的是有利于申报单位加强对原料药合成的 起点控制,最大限度地降低可能引入的杂质,保证终产品的纯度。审评中发现申报资料部分研究单位往往忽视制订起始原料的内控标准,或者即使制定,也不是结合 起始原料的工艺设定合理的质控项目(比如未结合工艺,制定相应的杂质控制以及残留溶剂控制)。2、缺少反应终点的监测方法与中间体质控方法。对于反应终点的监测以及中间体的控制,是构成产品质量控制体系的一部分重要内容。建议研发者尽量采用TLC等方法监测反应进程,对关键中间体应建立HPLC法等定量分析方法进行质控,以保证工艺与质量的稳。尤其需要强调的是目前手性原料的合成中,对引入手性的原料、中间体的控制过于粗略。研究单位多采用比旋度的方法对手性原料药合成中的关键原料及中间体进行 光学活性控制,但比旋度对光学纯度的质控而言,是个较为粗略的指标,其数值受样品的化学纯度、水分等的影响而会产生较大的波动,无法较准确体现样品的光学 纯度。同时,由于手物尤其是多个手性中心的药物空间结构确证以及质量控制仅依靠终点控制有一定难度,通常尚需结合起始材料以及中间体的情况进行判断, 故建议此类药物合成中采用手性HPLC法、毛细管电泳等更具专属性的方法控制相关样品的光学纯度。(二)、结构确证 1、结构确证中的对照品问题:结构确证不一定都要使用对照品,在没有对照品时,只需根据结构确证的一般原则:在全面分析化合物结构特征的基础上,结合制备 工艺、文献数据等已有的研究信息,选择针对性强的分析方法来确证化合物的结构。如果选用对照品,则需关注对照品选择的合理性:如以自研产品精制后样品作为 对照品,对结构确证而言,无专属性及特异性意义,因此并不适宜作为结构确证时的对照品;以上市制剂中提取、精制的原料为对照品,可作为部分结构确证时使 用,但由于提取、精制用溶剂及方法的差异,此类对照品与样品有可能存在晶型等方面的差异,故不适宜作为DSC、TG、粉末X-射线衍射等测定时的对照品。2、对口服固体制剂所用的难溶性原料药,缺少对样品晶型的研究晶型不同,可能会影响到产品的稳定性以及溶解性(最终影响生物利用度),为减少临床研究 的风险,建议对难溶物加强晶型研究。可采用不同的精制方法获取具有潜在晶型差异的样品,并对这些样品进行IR或粉末X-射线衍射测定以确定样品是否具 有多晶型,对具有多晶型的样品尽可能选择成熟路线制备晶型热力学稳定的样品作为制剂的原料,同时应兼顾不同晶型样品的溶解度。(三)质量研究与质量标准 该部分研究是存在问题最多的部分,最突出的是有关物质、残留溶剂方法建立的合理性、可操作性及质量可控性。1、有关物质检查:有关物质检查,包括对产品中残留合成原料、中间体、副产物及可能的降解产物的检查,是控制药品质量的重要指标,同时也是药品稳定性评价中需重点考察的项目。其方法学研究需关注以下几个项目:(1)有关物质检查波长的选择:当采用HPLC法,检测器为紫外检测器时,检测波长选择是否合理直接影响到杂质种类、数量的检出,因此检测波长的选择是 方法学研究的重要内容。审评中常见的问题包括: 直接或间接地以主成分的最大吸收波长作为检测波长,由于有关物质检查的对象是杂质,若将主药的最大吸收波长确定为检测波长,则杂质在此波长下的吸收可能偏 低,某些杂质甚至无吸收,这样会造成对杂质含量的低估甚至漏检,从而不能反映产品的真实质量。以样品进行破坏性试验(酸、碱、热、光照、氧化等)后的溶液 做紫外扫描,将扫描图谱中最大吸收波长确定为有关物质的检测波长。因破坏性试验后溶液中存在尚未破坏的主药、降解产物、辅料等,此溶液的紫外吸收为各成分 紫外吸收的加和,并不能反映降解产物的紫外吸收特性。由于未破坏主药所占比例较大,故破坏性试验后溶液的最大吸收波长一般仍为主药的最大吸收波长。因此在有关物质检查的波长选择时,首推通过二极管阵列检测器考察合成用原料、各中间体、各降解产物、主药的紫外吸收特征,或至少通过紫外扫描的方法考 证上述各样品的紫外吸收特征,选择杂质与原料相近的响应值处的波长为有关物质检查波长。对于响应值相差较大的杂质,应建立相应的检查方法及检测波长,或采 用加校正因子的自身对照法。(2)流动相筛选及方法学验证:从目前原料药的审报情况来看,在流动相筛选及方法学验证中,采用强力破坏以获得各种降解产物,并考查各降解产物与主药的分 离度的方法已被申报单位接受并认同,易被申报单位忽视的是对合成用原料、中间体与主药间分离度的考证。而对于原料药而言,这恰恰是原料药流动相筛选及考证 的重点,尤其是对于已有国家标准的原料药,验证国家标准终收载的有关物质检查方法是否适合自研产品的检验,由于合成工艺的可能不同,需重点验证合成用起始 原料、中间体同主药的分离情况。2、残留溶剂:原料药中的残留溶剂系指在原料药生产中使用,但在工艺过程中未能完全去除的有机溶剂。申报情况反映对于残留溶剂的检查可能存在以下问题:(1)研究内容不全面:未进行或只进行部分残留溶剂的检测,原料药中残留的有机溶剂特别是二类以上溶剂可能会对药物的安全性产生重大影响,其研究的重要性 不言而喻,由于历史原因,部分国家标准未制定有机溶剂检查项,但随着药检技术的发展和对残留溶剂认识的提高,残留溶剂研究成为必要的研究项目,需根据考察 结果(尤其是大生产样品的检验结果)确定是否应将该项检查定入质量标准。对制剂过程中使用的有机溶剂也建议考察其残留情况,特别是脂质体、缓、控释微丸包 衣过程使用的有机溶剂更应引起注意。一般情况下一类溶剂应禁止使用,如要使用,必须首先进行替代试验,证明在合成工艺中无法用其他溶剂替代。一类不论是在 起先还是后续的反应中使用,均应在产品中检测控制。(2)方法学研究不完整:采用GC顶空法进行测定时,研究过程中往往忽视两个非常重要的参数:顶空的平衡温度和平衡时间。平衡温度影响分配系数,并与平衡 时间相关,略高的平衡温度可以缩短平衡时间。平衡时间本质上取决于被测组分分子从样品基质到气相的扩散速度,由于样品的性质千差万别,因此平衡时间难以预 测,需通过一定平衡温度下的试验确定,以保证样品中有机溶剂的充分释出。通过研究确定合理的平衡温度与平衡时间保是保证顶空法测定残留溶剂结果可靠性的重 要前提。(3)检测器选择不当:气相的检测器用于残留溶剂的测定时最常用的是火焰离子化检测器(FID)、热导检测器(TCD)、电子捕获检测器(ECD)。申报 资料中存在的主要问题是忽视研究对象的结构特征,不加研究及选择地使用某一种检测器,如被研究对象是三氯甲烷、四氯化碳等仅含一个活泼氢或不含活泼氢的化 合物,却采用了FID检测器,导致测定结果的不可靠。(四)稳定性考察1、考察项目设置不合理:稳定性研究的考察项目应选择在药品保存期间易于变化,并可能会影响到药品的质量、安全性和有效性的项目,以便客观、全面地反映药 品的稳定性。根据药品特点和质量控制的要求,尽量选取能灵敏反映药品稳定性的指标。目前申报情况反映,有些申报单位易忽视产品的特点,仅以常规或专属性较 差的考察项目代替样品个性的考察,如对手物不考察光学异构体的变化或仅以比旋度进行粗略考察,对于易吸湿的药物不进行水分或干燥失重检查,无法全面、 真实反映样品的稳定性。2、稳定性研究中采用的方法与质量标准的方法不一致。质量标准中的方法是研究者在研发中,经过比较,认为相对合理的、可控制产品质量的方法,因此,两部分 研究中方法应尽量保持一致,以加强对结果的判断。如产品在研发过程中,质控方法进行了修订,需要分析方法变更前后对检验结果的影响。徐州宏鑫医药化工有限公司位于风景秀丽的徐州工业园区,园区地理位置优越,交通便利。
常用的溶剂提取法有哪几种?各有什么特点
药品中的残留溶剂系指在原料药或辅料的生产中,以及在制剂制备过程中使用的,但在工艺过程中未能完全去除的有机溶剂。在原料药合成工艺中,选择适当的溶剂可提高产量或决定药物的性质,如晶型、纯度、溶解速率等。因此有机溶剂在药物合成反应中是必不可少和非常关键的物质。下图为阿莫西林合成路线,使用了三乙胺((C2H5)3N)。
阿莫西林合成路线图
当药品所含的残留溶剂水平高于安全值时,就会对人体或环境产生危害,应尽可能除去所有残留溶剂,以符合制剂质量标准、生产质量管理规范(GMP)或其他质量要求。
《中国药典》2020年版《0861残留溶剂测定法》通则主要根据ICH《IMPURITIES: GUIDELINE FOR RESIDUAL SOLVENTS Q3C(R7)》制定,药品中残留溶剂根据安全性主要分为4类,共涉及70种溶剂。
01检测项目及限量值增修订变化
● 异丙基苯从第三类溶剂(限度0.5%)修改为第二类溶剂(限度为0.007%)
● 甲基异丁基酮从第三类溶剂(限度0.5%)修改为第二类溶剂(限度为0.45%)
● 增加三乙胺(齐多夫定、拉米夫定等需要检测)为第三类溶剂,限度为0.5%
● “四氢噻吩”修改为“环丁砜”,限度仍为0.016%
02 ICH Q3C(R8)征求稿
2020年4月29日国家药品监督管理局药品审评中心(CDE)在官网上发布了“关于公开征求ICH《Q3C(R8):杂质:残留溶剂的指导原则》指导原则草案意见的通知”。本次征求稿增加了3种溶剂限量要求,具体变化如下:
03产品标准执行变化
2020版药典二部化药共有249个品种标准在检查部分收载“残留溶剂”项目,相比2015版药典,42个品种新增订残留溶剂项目。经统计汇总,2020版药典化药二部234个品种标准残留溶剂项目说明了具体的检测方法(需要检测溶剂种类、对照、供试品溶液制备、色谱条件、系统适用性要求),“二甲磺酸阿米三星”、“乌苯美司”、“双环醇”等15个品种标准残留溶剂并没有说明具体检测方法,仅提到引用0861通则,其中12个是2020版药典新增品种。
01分析仪器及附件
02常用色谱柱选型方案
01 GC结合HS-20顶空进样器测定药品中18种溶剂残留
18种溶剂标准溶液色谱图
使用纯水配制溶剂残留混合标准系列溶液,每1mL含各种溶剂浓度分别为0.1、0.5、1.0、2.0、5.0?g,制作标准曲线,线性良好。根据0.1μg/mL标准溶液数据,计算方法检出限(3倍噪声计算)。各组分检出限见下表,检出限均达到通则限度1/30以下,且峰面积重现性良好(顶空进样精密度RSD应达到10.0%以内)。
将溶剂残留混标溶液添加到市售小儿氨酚烷胺颗粒中,按照样品前处理方法制备,样品中加标浓度分别为0.5 μg,样品加标回收率为87.89 ~117.46%。
02 GCMS结合HS-20顶空进样器测定药品中19种溶剂残留
19种溶剂混标溶液总离子流色谱图
使用纯水配制溶剂残留混合标准系列溶液,每1mL含各种溶剂浓度分别为0.1、0.5、1.0、2.0、5.0?g,制作标准曲线,线性良好。根据0.1μg/mL标准溶液数据,计算方法检出限(3倍噪声计算)。各组分检出限均远低于通则限度1/1000以下,且峰面积重现性良好(顶空进样精密度RSD应达到10.0%以内)。
将溶剂残留混标溶液添加到市售小儿氨酚烷胺颗粒中,按照样品前处理方法制备,样品中加标浓度分别为0.5 μg,样品加标回收率为75 ~102%。
03 顶空-GC 法测定ICH Q3C(R8)征求稿中3种溶剂残留
3 种溶剂残留混标溶液的色谱图(1.0 ?g)
使用去离子水配制溶剂残留混合标准系列,每1mL含各种溶剂浓度分别为 0.1、0.2、0.5、1.0、2.0、5.0、10.0 ?g 的混标系列溶液。根据 0.1 ?g 标液数据,以 3 倍信噪比(ASTM)计算检出限,各物质线性相关系数及检出限、重复性(顶空进样精密度RSD应达到10.0%以内)测试结果如下表:
检测甲磺酸倍他司汀原料药,按照样品前处理方法制备,样品中加标浓度分别为0.2 μg,0.2 μg 加标平均回收率在 88.4%~97.4% 之间。
浸渍法:浸渍法是将原料用适当的溶剂在常温或温热条件下浸泡出有效成分的一种方法。具体做法是: 取适量粉碎后的原料,置于加盖容器中,加入适量的溶剂并密盖,间断式搅拌或震摇,浸渍至规定时间使有效成分浸出。取上清夜,过滤,压榨残渣,合并滤液和压榨液, 过滤浓缩至适宜浓度, 可进一步制备流浸膏, 浸膏,片剂,冲剂等。 按提取温度和浸渍的次数可分为冷浸溃法,热浸溃法,重浸溃法。
渗漉法:渗漉法是将原料粗粉湿润膨胀后装入渗波器内,顶部用纱布覆盖,压紧,浸提溶剂连续地从渗涟器的上部加入, 溶剂渗过原料层往下流动过程中将与有效成分浸出的一种办法。 不断加入新溶剂, 可以连续收集浸提液, 由于原料不断与新溶剂或含有低浓度提取物的溶剂接触, 始终保持一定的浓度差, 浸提效果要比浸溃法高,提取比较完全,但溶剂用量大。渗滚法可分为单渗漉法,重渗漉法,加压渗漉法,逆渗漉法。
煎煮法:煎煮法是指用水作溶剂,将被提物加热煮沸一定时间,以提取其所含成分的一种常用方法, 又称煮提法或煎浸法。 该法是将原料适当的切碎或粉碎成粗粉放入适当容器中,加水浸过原料面,充分浸泡后,加热煎煮2一3 次,每次l h左右。直火加热,要不断搅拌以免焦糊。分离并收集各次煎出液,经离心分离或沉滤过后,浓缩至所需浓度。该法使用于有效成分能溶于水, 对湿,热均稳定且不易挥发的原料。
回流提取法: 回流提取法是用乙醇等易挥发的有机溶剂提取原料成分,将浸出液加热蒸馏,其中挥发性溶剂馏出后又被冷却,重复流回浸出容器中浸提原料, 这样周而复始,直至有效成分回流提取完全的方法。 回流法提取液在蒸发锅中受热时间较长,故不使用于受热易破坏的原料成分的浸出。
连续提取法:为了弥补回流提取法中需要溶剂量大,操作较繁的不足,可采用连续提取法。当提取的有效成分在所选溶剂中不宜溶解时, 若采用回流提取需提十几次, 既费时又过多耗费溶剂,在此情况下,可用连续回流提取法,用较少的溶剂一次提取便可提取完全。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。