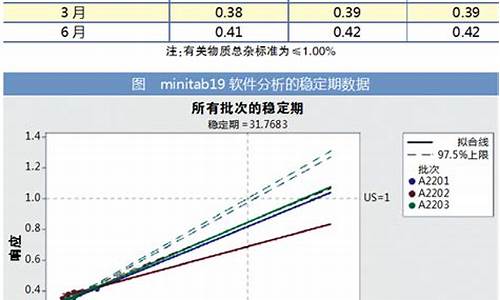
原料药物-原料药药毒理研究声明最新

这个问题就需要考虑是新药还是仿制药的问题,如果是因为药品注册而进行的临床研究。
一类新药(创新药):新物质新结构新化合物,主要是以文献为主,还可以查询产靠同类品的药物申报资料。
二类新药(改良药):在已有药物基础上进行改良,比如改剂型,新适应症等这些还是需要查询参考文献,还有就是原研药相关的临床研究资料有一定的参考价值。
仿制药是其中相对于比较简单的一种,主要是了解原研药临床前研究,能在数据库中搜索到相对完整的申报资料,这些资料有助于辅助药品申报。
在数据库中有全球医药文献数据、药理毒理数据、还有药物报告数据,查询临床前药物研究资料。
临床前查询医药文献数据
药理毒理数据
药物报告
一般用来申报临床前的资料都需要靠查询文献,创新药以文献查询相关资料为主、相同类别申报包资料为辅,改良型新药可以查询原研药临床前资料,相关文献,仿制药主要是查询是原研药哪里批准的在数据库中可以直接查询完整的申报资料。
以上就是药物临床前的研究资料了,以上这些数据能针对药物注册,在药物报告中,包含原料药工艺的研究、制剂处方和合成工艺确证化学结构或组分的试验,药品质量试验,药品标准起草及说明,样品检验,辅料,稳定性试验、包装材料和容器有关试验等,还有药理毒理数据等。
高瓴资本又出手CXO!
根据国家药品监督管理局发布的《药品注册管理办法》(局令第28号),化学药品注册的需按照法规对申报药品进行分类。对于化学药品的注册分类共分为6类。原文可下载《药品注册管理办法》(局令第28号)的附件2查看。
1、未在国内外上市销售的药品。细分如下:
(1)通过合成或者半合成的方法制得的原料药及其制剂;
(2)天然物质中提取或者通过发酵提取的新的有效单体及其制剂;
(3)用拆分或者合成等方法制得的已知药物中的光学异构体及其制剂;
(4)由已上市销售的多组份药物制备为较少组份的药物;
(5)新的复方制剂;
(6)已在国内上市销售的制剂增加国内外均未批准的新适应症。
2、改变给药途径且尚未在国内外上市销售的制剂。
3、已在国外上市销售但尚未在国内上市销售的药品。细分如下:
(1)已在国外上市销售的制剂及其原料药,和/或改变该制剂的剂型,但不改变给药途径的制剂;
(2)已在国外上市销售的复方制剂,和/或改变该制剂的剂型,但不改变给药途径的制剂;
(3)改变给药途径并已在国外上市销售的制剂;
(4)国内上市销售的制剂增加已在国外批准的新适应症。
4、改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药及其制剂。
5、改变国内已上市销售药品的剂型,但不改变给药途径的制剂。
6、已有国家药品标准的原料药或者制剂。
扩展资料
化学药品制剂行业一直以来都是我国医药工业中的优势子行业,具有高技术含量、高资金投入、高风险、高收益和相对垄断的行业特征。从价值链来讲,化学药品制剂处于价值链高端,按价值递增依次为通用名药(非专利药)和专利药,专利药是整个价值链的顶端。
化学药品制剂涉及国民健康、社会稳定和经济发展,是国民经济一个特殊而重要的产业。改革开放30年以来,我国化学药品制剂工业的发展驶入快车道,近几年的工业总产值增长率都保持在18%以上,销售收入增长率基本保持在20%以上。
从发展趋势看,化学药品制剂行业即将进入快速发展期,未来发展空间巨大,但利润分配将更加不均衡,行业集中度将进一步提高,具有研发、规模和产品优势的企业将强者恒强。
中国化学药品制剂行业已经完全发展成为一个竞争性的行业,在国际上的影响力也有所提高。在中国内地,外资及合资制药企业与内资制药企业之间的市场竞争非常激烈,尤其是近两三年,外资及合资企业大幅增加在华投资,强化市场力度。
截至2011年底,中国大陆规模以上的化学药品制剂企业有1032家,经过快速发展阶段和激烈的市场竞争的锤炼,基本格局初步形成。外资及合资制药企业占据着中国化学药品制剂的高端市场,但内资品牌也正在逐步进军高端。
百度百科:化学药品
新药的开发研制过程是怎样进行的?
拥有了药明康德,泰格医药,凯莱英等CXO等第一梯队公司之后,高瓴资本还不满足,昨晚再次出手博腾股份。
博腾股份(300363)16日晚间公告,二级控股子公司苏州博腾生物制药有限公司(简称 “苏州博腾”)拟引入外部投资者,具体包括先进制造二期基金、高瓴辰钧、惠每健康、南京瑞联、苏州时节启扬。
关于博腾股份的基本面分析,各种机构研报说的够多了,但总有一个问题,医药行业本身的专业性,出发点太高,普通投资者很难看懂。此文想通俗讲一讲,行家请略过,希望不会把各位绕进去。
大部分人认识博腾是二、三月份的新冠病毒刚爆发时,世面流传瑞德西韦抗病毒的有效性,作为瑞德西韦中间体的主要供应商,市场好比渣男抱着玩弄女方的态度,对博腾短期爆炒了一番。现在来看,渣男走后并没有留下一地鸡毛,谁玩了谁还真不好说。
医药行业是唯一既有消费属性又有科技属性的版块,所以和难懂的科学术语一样,一堆专业医药术语让人看着头疼。博腾是做CMO起家的,说直接点就是医药中间体代加工,像富士康一样给别人打工的代工厂,不过相比一般的中间体化工厂,博腾的GMP中间体更高端,因为做好了GMP才能做好原料药,GMP简单理解就是一种要求和规范,对实验室工作环境要求极高,把普通的有杂质的中间体精炼去杂去菌,类似食品级要求,进化过程:普通中间体>GMP中间体>API原料药>制剂。
博腾当前成功转型到了API原料药,制剂也有部分产能和收入,新车间将陆续投入使用,下一步是扩大产能做到API和制剂一体化,也就是我们通常讲的药物成品,多了原料合成和定形等。结合这些知识再回过头来讲CDMO,比CMO一字之差天壤之别,多了个Development发展,研发之意。相比CMO代工,CDMO多了工艺设计研发,包括non-GMP、GLP、GMP试产,质量、工艺检验,安全评估,处方前研究,药物结晶等等。再白话下,转型前就是客户设计好药物,将药物组成的一个部件图纸交给博腾,让博腾批量提供,然后拿着博腾提供的部件自己组装或者找另一家有能力的代工厂组装成成品。现在把整个图纸给博腾让提供药物成品并注册,客户只管品牌和市场营销完事。
这里如果我只要你研发不要你量产,那就叫CRO了,CRO分早期发现,毒理,临床安评等,博腾不做这一块,博腾做CRO后期药学研究,工艺和制造。化学CDMO也可以看成CRO和CMO的结合,所以想提前预判博腾的业绩,看他的CRO接单数量就知道了。同理,博腾也会根据CRO的接单情况对应建设匹配新的API和制剂车间,避免了盲目扩张。创新药的小客户群体占90%,客户粘性好,更愿意接受API到制剂一体化服务,把商业化量产也交过来,因为这样不会出现研发端和量产端不同供应商之间的扯皮。
从未来业绩增长上看,同其他CDMO企业一样,博腾的CRO业务从去年3季度就接不过来了,一直排到今年下半年,包括JSTAR,去年在建的109车间今年会投入使用,正好去匹配新的产能需求。在第二梯队的CDMO企业中,博腾股份和九洲药业无疑最有机会追赶上第一梯队,相比九洲,博腾在技术和管理层上更胜一筹,九洲的优势是绑定了诺华,未来业绩确定性高,市场也给了高估值,缺点是大客户集中度又提高了,大客户出点问题容易受影响,且在API上并不具备突出优势,制剂布局上更是落后于博腾。再来对比两家海外布局,博腾收购的JSTAR无论是在体量和技术上都比九洲收购的PharmAgra强太多,JSTAR有20多年行业经验,CRO工艺开发是强项,特别是博腾整合了JSTAR全球领先的药物结晶技术,使原料的质量和稳定性达到顶级的层次,无疑会吸引更多的客户眼光。
一个公司好不好先看公司的管理层,管理层好不好看他的格局够不够大,聚焦在战略,战术,还是战役上,除了化学药CDMO,博腾正在切入生物药CDMO,就是药明生物玩的那套,生物药里增长最快的是基因细胞治疗,其次才是抗体,博腾正优先发展基因细胞,佩服博腾管理层的战略眼光。新车间的生物药CDMO已经超预期拿到多个项目,反观九洲药业,管理层提出未来公司战略规划是CDMO和API双轮驱动,相比博腾少了生物药,同样九洲也意识到生物药的蓝海市场,总经理说市场前景很好,蛋糕很大,药明是龙头,其他二三线都刚开始不经打,会另外找适合的机会介入。客套话谁都会说,说白了就是暂时没有这个能力介入。
CXO这几年风风火火,一线品种基本都在天上,如果没有买上,又恐高的,不妨从二线品种里优中选优。预计博腾2020年每股收益达0.61,21年0.82,22年1.11。22年对应PE49倍。
本次高瓴资本的介入,应该是看好公司未来的基因细胞CDMO。
新药研究开发的过程
研发过程需要经过药物的设计与筛选、化学合成与改造、药剂学与药动学研究、工艺与制剂、质量检测与控制、安全性与临床评价、市场反馈等等许多步骤,面临问题复杂。
按照工作内容的不同可将新药研发分为四个阶段:发现和甄别、临床前研究、临床研究、新药申报及后续工作。
第一、发现和甄别包括基础研究和应用研究(包括药品制备和初筛),发现和筛选药物来源。
第二、临床前研究包括为了确定药物安全性和有效性所作的实验和动物试验及其准备工作,既药学、药效、药理和毒理并进行临床申报。
第三、临床研究包括I(初步临床药理学研究、人体安全性研究),II(治疗作用初步评价、安全性研究,III期临床试验及其准备工作(扩大临床试验、特殊临床试验、补充临床试验、不良反应观察)。
第四、新药申报及后续工作包括新药申报,以及由于SFDA(国家食品药品监督管理局)对新药申报进行复查所要求做的额外工作。
新药研发流程
新药研究开发的过程是十分漫长而复杂的。简单地说一下,申报材料大致是四个部分:
1.综述资料
2.药学研究资料
3.药理毒性研究资料
4.临床研究资料
后三个部分都要经过严格的实验,反复观察,通过数据得出可靠的结论,才能作为真实的资料用于申报新药。尤其是临床研究部分。
但是,说实话,在中国,大多数新药都是改变一下给药途径,改变一下药物的某个基团、剂型等等,没有本质上的新药在研究开发出来。
中国一年内注册的新药是美国的几百倍,为什么?因为药监局是很喜欢有新药注册的,这个不详细说了。
什么样的原研药适合开发成仿制药呢?
药物的发现阶段。目的是找出有潜力成为药物的候选化合物。
通过了解疾病的发病过程及机理,为新药开发提供明确的靶标。通过从已有的天然药物,或通过靶标,定向设计出对于靶标有作用的先导化合物。lead-compound
围绕天然药物或者其他方面得到的先导化合物,通过对这些化合物活性数据与构效关系分析,如利平斯基五倍率法则,进一步指导后续化合物结构优化和修饰,以得到更好的化合物。
通过构效关系及活性研究,筛选出来具有满足要求(药物设计目的)的最优化合物,通过某些指标,如类药性,生物利用度,血脑屏障透过系数等。通过大规模数据、算法进行预测,以选择合适的化合物。
此时药物已进入开发阶段。首先需要完成临床前的毒理学研究,向药监部门提交“实验用新药”申请 investigational new drug, IND 。
首先需要提供一批次的原料药以用于毒理研究(100-1000g)。此阶段需要尽快完成,只要药物合成路线(或提取方式)能够满足批量获取,一般就能够获得批准,包括成本等此时不必主要考虑
但同样,随着药物研发项目的后续推进,工艺部门也应当根据需要(商业化等)不断优化合成路线与方法,开发合理的生产工艺与合成路线,满足从I—III期临床用药与商业化的需求。
了解药物在体内的吸收、分布、代谢、排泄的相关数据。用于指导研究给药方式(口服、注射等),给药频率与剂量。
证明药物对目标疾病有特定的治疗效果。并根据药代动力学的研究结果,评估药物的安全治疗剂量范围。
毒理研究种类较多,一般来说包括急性、亚急性、慢性毒性,或致癌、致突变、生殖毒性等的研究。
根据药物开发的时间需求,毒理学的研究在时间维度上可以进行相应的调整。
根据之前的临床前研究结果,根据药物的药代动力学数据,及药物的治疗目的,选择合适的给药方式与处方制剂。并对于设计好的制剂,也应进行同样的安全性及动力学评估。
当一个化合物通过了临床前研究阶段,就需要向药监部门提交新药临床研究申请。以开展药物的临床研究。
此时需要提供先前实验的材料:化合物的结构,给药方式,毒理学研究等;以及临床实验的相关计划:在何地,由谁以及如何进行临床试验。
所有的临床方案必须经过伦理审评委员会(InstitutionalReview Board,IRB)的审查和通过,并在后续执行过程中,每年向药监部门及伦理审评委员会汇报临床实验的进程和结果。
在美国,如果新药申请在提交后的30天内FDA没有驳回,那么该申请则视为有效,可以进行人体实验。在中国则需要NMPA(原CFDA)批准。
将药物第一次用于人体以研究药物性质的实验,一般也称为耐受性实验。Ⅰ期临床试验一般需要征集20-100名 正常和健康的志愿者 (对于肿瘤药物而言则通常为肿瘤病人)。
在严格控制的条件下,给不同的剂量(安全性得到进一步评估后可以进行多剂量给药)于志愿者,住院以进行24小时的密切监护,监测药物的血液浓度,其吸收、分布、代谢和排泄以及药效持续时间的数据,有益或不良反应,评价药物在人体内的性质。为将来为病人使用提供合适剂量。
为了证实药物的治疗目的,则会进一步执行Ⅱ期临床试验,也是在 病人 身上做的实验。 Ⅱ期的临床试验通常需要100-500名病人进行实验。
通过检测与Ⅰ期临床试验相似的药代动力学数据,以及药效,确定药物在实际病人上的有效性与安全性。
Ⅱ期临床试验一般采用随机盲法对照试验(也可采用其他形式),及在病人和医生都不知道的情况下,分别给不同病人给予对照组与实验组的药物。
Ⅲ期临床以商业化生产工艺提供用药。而原料药与制剂工艺,也应推到至这一阶段,一般来说,此时的药物生产应考虑多个方面,包括:产品质量,成本,安全性,稳定性,可持续性,及环境影响。
Ⅲ期临床一般需要1000-5000名病人。相比起Ⅱ期临床试验,则是在更大范围的病人身上进行实验,以获得大样本的数据。根据统计学分析,判断药物有效性与安全性。以及药物相比市场上的老药(同类型治疗目的的已上市的药物),新药是否有更好的治疗效果。
除此之外,三期临床实验还应关注 老年人 及 儿童用药 (若该药适用)。一般从安全性考虑,老年人与儿童相比,对药物耐受更低。一般儿童参加的临床试验,在Ⅲ期临床试验后进行。
一般来说三期临床可能持续数年时间。
在完成全部三期临床实验后,并分析所有数据,证实药物的有效性与安全性后,则可以向药监部门递交新药申请。一般新药申请程序比较复杂,且相关文件过多,处理时间也比较长。参考FDA,规定新药申请应在6月内审批完成。
在获得药监部门批准新药申请文件后,药物即可正式上市,供医生与病人选择。但新药持有者需持续向药监部门递交药物副作用及质量管理相关资料。某些药物还会要求做 IV期临床试验,以观测长期副作用。
四期临床又称为,药物上市后监测研究。药物在大规模人群使用后,还需对其疗效与不良反应进行评估,药监部门要求根据这一结果来修订药品使用说明书,包括药物配伍使用,药物使用禁忌。如果上市后发现有之前未被发现的不良反应,药品还会被药监部门要求加注警告,严重者甚至被要求下架。
首先了解什么是原研药和仿制药
原研药:一般也可以被称为专利药,是从千万种化合物层层筛选出的,在通过严格的临床试验批准审核之后注册上市的,一般原研药从研发到注册上市的时间需要15年左右,有些还不止,耗资也是数亿美元,这种药在专利期之前是不可以被仿制的。
仿制药:当原研药过了专利保护期之后可以被其它企业仿制,这类药物就叫作仿制药。
什么样的原研药适合开发仿制呢?
1、首先了解自己研发团队资源、融资成本、资源、领域等问题。
2、选择适应症患者基数大的,患者多的。
3、选择药物价格比较高的药物,因为仿制药进入集采之后,价格会压缩,利润空间变小。
4、首仿或者二仿,做第一个吃螃蟹的人。
5、有技术壁垒,打破原研药技术壁垒。
现在各种疾病的仿制药都有需求量大的和需求量小的,但是最优先的还是选择价格比较贵的,主要还是要看药企的研发管线,药物市场有没有这样的销售线。
结合以上怎么分析市场,了解适合自己的仿制药?
可以用数据库分析数据,通过上市药品数据分析价格比较高的药物,适合自身药企研发管线的药物。
根据自己研发团队资源,领域,资本等选择仿制方向,提供仿制药立项、研发、临床、市场销售数据等,助力药物研发、立项。
什么样的原研药适合开发成仿制药
列如“肺癌”类药物,可以在全球药物研发中查询,临床或者上市等不同阶段的药物,包括药物研发代码、研发企业、适应症、治疗领域、靶点、研发阶段、工艺技术等信息,同时扩展药物的研发状态、关键性临床以及销售额信息,在研新药市场变化,了解研发趋势。
原研药物
在全球上市药物中了解不同地区国家,上市药物信息,为药物研究和使用提供参考比对。
上市药物
在药品销售数据中了解,全国医院和全国药店的销售数据,了解市场销售数据,分析市场,计算投入产出比。
药品销售数据
在一致性评价数据中能查询一致性评价数据,过评药品数据,仿制药参比制剂数据,了解选择参比制剂。
原研参比制剂
除了这些还能查询临床申报、药品注册、医药专利、集采、原料药等数据,全面助力与仿制药的研发,当然数据库中的全球药物研发数据、全球医药文献数据、药理毒理数据等也能助力于新药的研发,为生物医药领域提供研发上的、市场上的的数据支持。
目前国内仿制药行业不断增长,因为国家不断出台政策鼓励优质仿制药的研发和使用,确保仿制药的质量和疗效,因为政策带动未来可能会有更多的高质量的仿制药研发上市,很多药企也会把握这种机会,选择适合仿制药研发。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。