原料药的定义和分类-原料药的含义
化药3+3类中前一个3是指原料药按3类注册申报,后一个3是指制剂也按3类注册申报;化药4+4类是指原料药按4类注册申报,其制剂按4类注册申报;化药3+6是指原料药按3类注册申报,其制剂按6类注册申报.
几加几,就指原料药按几类注册申报,其制剂按几类注册申报。
扩展资料
化学药品具体的注册分类办法如下:
一、化学药品注册分类
1、未在国内外上市销售的药品:
(1)通过合成或者半合成的方法制得的原料药及其制剂;
(2)天然物质中提取或者通过发酵提取的新的有效单体及其制剂;
(3)用拆分或者合成等方法制得的已知药物中的光学异构体及其制剂;
(4)由已上市销售的多组份药物制备为较少组份的药物;(5)新的复方制剂。
2、改变给药途径且尚未在国内外上市销售的制剂。
3、已在国外上市销售但尚未在国内上市销售的药品:
(1)已在国外上市销售的原料药及其制剂;
(2)已在国外上市销售的复方制剂;
(3)改变给药途径并已在国外上市销售的制剂。
4、改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药及其制剂。
5、改变国内已上市销售药品的剂型,但不改变给药途径的制剂。
6、已有国家药品标准的原料药或者制剂。
百度百科-化学药品
为什么化学药品的新药分为5类
化学药品原药制造
指供进一步加工药品制剂所需的原料药生产。
◇ 包括:
—制药用化学物质的制造,如抗菌素、内分泌品、基本维生素、磺胺类药物、水杨酸盐和水
杨酸酯、葡萄糖和生物碱等原料药;
—化学纯糖。
◆ 不包括:
—血和血浆等血液制品的生产,列入2760(生物、生化制品的制造)。 指直接用于人体疾病防治、诊断的化学药品制剂的制造。
◇ 包括:
—片剂、针剂、胶囊、药水、软膏、粉剂、溶剂等各种剂型的药品;
—放射物。
◆ 不包括:
—中成药制造,列入2740(中成药制造);
—动物用药制造,列入2750(兽用药品制造);
—生物制品和生化药品的制造,列入2760(生物、生化制品的制造)。 指对采集的天然或人工种植、养殖的动物和植物中草药进行加工、处理的活动。
◇ 包括:
—各种中药材经过加工、炮制后形成的中药饮片;
—其他提取中药的加工。 指直接用于人体疾病防治的传统药的加工生产。
◇ 包括:
—用中药传统制作方法制作的各种蜜丸、水丸、冲剂、糖浆、膏药等中成药;
—用现代制药方法制作的中药片剂、针剂、胶囊、口服液等;
—专作治病的药酒。 指用于动物疾病防治医药的制造。
◇ 包括:
—动物用化学药品、动物用抗生素、畜禽疫苗、中草药;
—饲料药物、水产养殖用药物等。
◆ 不包括:
—饲料添加剂(促生长剂)的生产,列入1494(食品及饲料添加剂制造)。 指利用生物技术生产生物化学药品、基因工程药物的生产活动。
◇ 包括:
—基因、细胞、酶、发酵工程药物、基因工程疫苗、新疫苗、菌苗;
—药用氨基酸、抗生素、维生素、微生态制剂药物;
—血液制品及代用品;
—诊断试剂:血型试剂、X光检查造影剂、用于病人的诊断试剂;
—用动物肝脏制成的生化药品。 指卫生材料、外科敷料、药用包装材料以及其他内、外科用医药制品的制造。
◇ 包括:
—外科敷料、药物填料:橡皮膏、药棉、绷带等;
—用于牙科医治的粘合剂、固化材料、生物材料、牙科用充填材料、正畸材料、印模材料、
研磨材料等;
—外科及牙科用无菌吸收性止血材料;
—骨折用绷带、肠线和其他手术缝合线;
—明胶制装药用胶囊等;
—医用高分子材料及制品的制造。
◆ 不包括:
—医用纱布的制造,列入1711(棉、化纤纺织加工);
—玻璃安瓿、药水瓶等医疗卫生用玻璃器皿的生产,列入3144(玻璃仪器制造);
—药用铝箔的生产,列入3489(其他日用金属制品制造);
—药用包装复合膜的生产,列入3010(塑料薄膜制造);
—牙医配的假牙、人工器官等制造,列入3686(假肢、人工器官及植(介)入器械制造);
—医用橡胶制品制造,分别列入橡胶制品制造中的2920(橡胶板、管、带的制造)、2950(日
用及医用橡胶制品制造);
—医用塑料制品制造,列入3090(其他塑料制品制造)。
药品是怎么分类的
化学药品
第一类:首创的原料药及其制剂。
1.通过合成或半合成的方法制成的原料药及其制剂。
2.天然物质中提取的或通过发酵提取的有效单体及其制剂。
3.国外已有药用研究报道,尚未获一国药品管理当局批准上市的化合物。
第二类:
1.已在国外获准生产上市,但未载入药典,我国也未进口的药品。
2.用拆分、合成的方法首次制得的某一已知药物中的光学异构体及其制剂。
3.国外尚未上市的由口服、外用或其他途径改变为注射途径给药者,或由局部用药改为全身给药者(如口服、吸入等制剂)。
第三类:
1.由化学药品新组成的复方制剂。
2.由化学药品与中药新组成的复方制剂并以化学药品发挥主要作用者。
3.由已上市的多组份药物制备为较少组分的原料药及其制剂。
4.由动物或其组织、器官提取的新的多组分生化药品。
第四类:
1.国外药典收载的原料药及制剂。
2.我国已进口的原料药和/或制剂(已有进口原料药制成的制剂,如国内研制其原料药及制剂,亦在此列).
3.用拆分或合成方法制得的某一已知药物中国外已获准上市的光学异构体及制剂。
4.改变已知盐类药物的酸根、碱基(或金属元素)制成的原料药及其制剂。此种改变应不 改变其药理作用,仅改变其理化性质(如溶解度、稳定性等),以适应贮存、制剂制造或临床用药的需要。
5.国外已上市的复方制剂及改变剂型的药品。
6.用进口原料药制成的制剂。
7.改变剂型的药品。
8.改变给药途径的药品(不包括第二类新药之3)。
第五类:已上市药品增加新的适应症者。
1.需延长用药周期和/或增加剂量者。
2.未改变或减少用药周期和/或降低剂量者。
3.国外已获准此适应症者。
q7a与中国GMP在原料药上的一些差异
根据《中华人民共和国药品管理法》关于药品的定义:药品分为处方药和非处方药。
药品按照性质分类包括:
1、中药材;
2、中药饮片;
3、中成药;
4、中西成药;
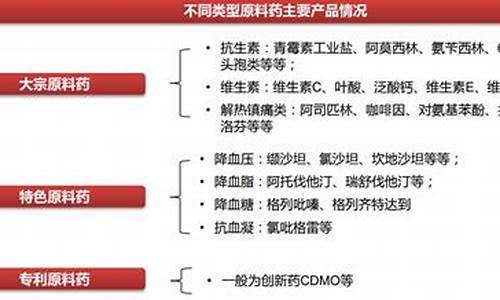
5、化学原料药及其制剂;
6、抗生素;
7、生化药品;
8、放射品;
9、血清;
10、疫苗;
11、血液制品;
12、诊断药品等;
/iknow-pic.cdn.bcebos.com/8435e5dde71190efaece04c0c11b9d16fdfa60fc"target="_blank"title=""class="ikqb_img_alink">/iknow-pic.cdn.bcebos.com/8435e5dde71190efaece04c0c11b9d16fdfa60fc?x-bce-process=image%2Fresize%2Cm_lfit%2Cw_600%2Ch_800%2Climit_1%2Fquality%2Cq_85%2Fformat%2Cf_auto"esrc=""/>
扩展资料:
药品的特性:
1、类型复杂度:全球约有2万种特定品种,中国有5000多种中药制剂和4000多种西药制剂。可见,药物种类复杂多样。
2、药物的医学专一性:药物不是一种独立的商品,它们与医学紧密结合,相辅相成。只有在医生和执业药师的指导下,通过对医生的检查诊断和合理用药,患者才能达到预防疾病、保护健康的目的。
3、药品质量的严格性:药品直接关系到人们的健康甚至生命,所以药品质量不能有一点马虎。必须保证药品的安全性、有效性、一致性和稳定性。
/baike.baidu.com/item/药品/383716#6"target="_blank"title="只支持选中一个链接时生效">百度百科-药品
GMP与Q7a的不同点:
为了严格管理药品,必须对药品的研制、开发、生产、销售、进品等进行审批,形成药品的注册制度,不同国家对药品注册要求各不相同,这不利于国际技术和贸易交流,造成人类社会资源浪费,不利于人类医药事业的发展,因此,客观上有必要就药品注册问题进行国际性的共同协商,在主要问题上取得一致,由美国、日本和欧盟三方的政府药品管理部门和制药行业在1990年发起的ICH(人用药物注册技术要求国际协调会议,International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use)就是这样应运而生的。ICH是由指导委员会、专家工作组和秘书处组成。秘书处设在日内瓦。ICH文件分为质量、安全性、有效性和综合学科4类。其中,质量技术要求文件以Q开关,分别以1、2、3、4、5、6和7代表药品的稳定性、方法学、杂质、药典、生物技术产品质量、标准规格和GMP,再以a,b,c,d代表小项,Q7a(原料药的优良制造规范指南)就代表GMP方面唯一的一项----药物活性成分(通常指原料药)的GMP。
总的来说,Q7a和中国GMP 的精神、原则、主要内容和要求方面是一致的。但有许多方面确实有其特点性的不同:
1、 Q7a把GMP 提高到了必须建立质量管理体系的高度,要求“每家制造商都应该建 立、实施由管理人员和有关员工积极参加的、有效的质量管理体系,并形成文件。”(Q7a 2.11),但中国GMP没提高到这个高度。Q7a的这个要求和国际上ISO9000的发展是相适应的。质量管理发展到本世纪,已经形成了以 ISO9000为代表的一整套成熟的体系。ISO9000适合于各行各业,医药行业也不例外。GMP是制药行业的管理/技术规范,它本来应该早些和 ISO9000同步进行,但是,历史还是安排了一段进程距离。目前在ICH 中GMP和ISO9000已经同步了,但在国内制药界二者还有距离。
2、虽然Q7a没有像中国GMP那样规定质量管理部门直属企业负责人领导,但Q7a对质量管理部门所赋予的权力更权威更具体,明确规定企业所有的与质量有关的文件都要由质量管理部门审核和批准(Q7a 2.12),其中包括生产中所有的规格标准和主要的生产指导文件的批准、供应厂商的批准、生产中所有验证方案和报告的批准、与GMP有关的任何变更方案和报告的批准、与GMP 有关的任何变更方案的批准(Q7a 13.12)等等。
3、中国GMP虽然涉及原料药的一些内容,但对于原料药的专门规范还未出台。因此,一些基本概念未作规定。而Q7a首先对原料药作了定义和分类。
3.1 “在世界范围内对原料药的法定定义是各不相同的。但是,只要某种原料在某一国家或地区中被分类为原料药,并被用于医药品或医药品的制造中,则这种原料的制造过程应该符合本掼的规定。”(Q7a 1.2)
3.2 Q7a把原料药按“生产类型”分为:(1)化学品(合成品);(2)从动物源得到的原料药;(3)从植物源得到的原料药;(4)从草药提取的原料药;(5)从粉碎或粉末状草药得到的原料药;(6)从生物技术发酵/细胞培养得到的原料药(Q7a 1.3)
4、 Q7a要求产品质量回顾。中国GMP只在第83条提出自检要求(“药品生产企业应组织自检,自检应按预定的程序对人员、厂房、设备、文件、生产、质量控制、药品销售、用户投诉和产品的收回的处理等项定期进行检查,以证实与本规范的一致性”),尚未出现产品质量评审的概念和规定。Q7a除了有“同部审查(自检)”(Q7a 2.4)外,还提出了“产品质量评审”(Q7a 2.5)。在中国GMP对质量管理部门的主要职责要求中,也没有规定进行质量评审的工作,而Q7a在“质量部门的职责”中明确规定“开展质量评审活动” (Q7a 2.22)。
自检的目的是检查实操与规范的一致性,而评审的目的是探讨规范与客观的适合性;自检是评审的基础之一,评审是自检基础上的更高级活动。
5、Q7a增加了“计算机控制系统”(Q7a 5.4)的10点要求,这是中国GMP没有要求的内容,因为这一要求对我国许多药厂尚不现实。
6、Q7a对文件化的要求更普遍、更严格,贯穿在整个规定中。
例如:a、连原料药的生产从何阶段开始也要求定义和文件化说明(Q7a 1.3);b、“应该指定授权发放中间体和原料药的人员。”(Q7a 2.14);c、“所有有关质量的活动都应该在执行时加以记录。”(Q7a 2.15);d、“任何偏离确定程序的情况都应该有文字记录并加以解释。对于关键性偏差应该进行调查,并记录调查经过及其结果。”(Q7a 2.16)。e、“对于顾问的姓名、地址、资格和提供服务的类型都应该保留文字记录。“(Q7a 3.31)等等。
7、Q7a非常强调以数据说话,一切都要有充分理由,十分强调验证和审评。
除了在各大项中有这种要求外(甚至连培训效果也要求评估,这在中国GMP中不作要求),还有专门章节(Q7a 12)对验证加以详细规定:12.1验证方针(3项);12.2验证文件(4项);12.3确认(1项);12.4工艺验证文件文件(6项);12.5工艺验证程序(3项);12.6已验证系统的定期审核(1项);12.7清洗验证(7项);12.8分析方法验证(3项)。
有关验证工作一共有28项。而中国GMP“验证”一章只有4项。
8、Q7a具有一定灵活性,目的是使质量管理更切合实际,有利于/方便于生产。
例如:a、中国GMP规定“生产工艺规程、岗位操作法和标准操作堆积不得任意更改,如需更改,应按制定时的程序办理修订、审批手续”(第66条)。完全没有余地,无论大小更改都必须如此执行。但Q7a则认为“工序控制可以由有资格的生产部门的人员来实施。对于工艺的调节可以事先不经质量管理部门批准,只要相关调节在由质量管理部门批准的限度内。所有测试及结果都应该作为批记录的一部分加以记录。”(Q7a 8.33);b、中国GMP规定只有质量管理部门才有权决定物料和中间产品的使用(第75条)。但Q7a认为“质量部门可将发放中间体的职责和权力委派给生产部门,但不包括运往制造商控制范围以外区域的中间体。”(Q7a 6.73)
9、其他不同之处:a、Q7a对顾问人员作为单独一项提出,表示对其影响十分重视(Q7a 3.3);b、提醒在公用设施生产能力”在超出限度时应该采取相应措施。(Q7a 4.20);c、照明条件不但要在生产工位上得以保证,”应该向所有区域提供充足的照明,便于清洗、维护及其他操作。“(Q7a 4.50);c、“在保存期限内,记录的原件或副本都应保留在记录所描述的活动发生的场所。”(Q7a 6.15);d、“为确保各批产品的一致性,对于每一种中间体和原料的主要生产工艺应该由同一人来制定,标注时间及签名,并由质量部门的另一个人独立进行检查、标注日期及签名。”(Q7a 6.40);e、“在一批原较药放行或分发之前,关键工序的批生产记录和实验室控制记录应该由质量部门进行审核和批准。非关键工序的生产和实验室记录可按照经质量部门批准的程序,由有资格的生产人员或其它部门进行审核。”(Q7a 6.71)等等。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。