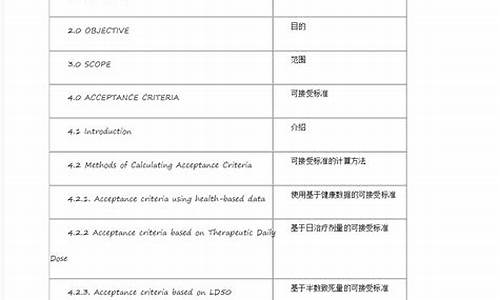
原料药元素杂质风险评估报告-原料药杂质限度是多少

2B类:元素银(Ag)、金(Au)、铱(Ir)、锇(Os)、钯(Pd)、铂 (Pt)、铑(Rh)、钌(Ru)、硒(Se)、铊(Tl),这些元素在自然界中稀少,在药品中出现的可能性较低。除非其在原料药、辅料或药品的其它成分生产中被有意加入,否则可被排除在风险评估以外。?元素杂质又称重金属,重金属原义指比重大于5的金属,元素杂质包括可能存在于原料、辅料或制剂中,来源于合成中催化剂残留、药品生产制备过程中引入或辅料中存在的、生产设备引入、或容器密闭系统引入。某些元素杂质不仅对药品的稳定性、保质期产生不利影响,还可能因为潜在的毒性引发药物副反应。因此欧盟、美国对杂质的控制越来越严格,对此项不断修订,中国在加入ICH后对此项检测应该也会向国际靠拢,因此了解法规对元素杂质的要求、建立有效的检测方法变得尤为重要。
新版的药典金属元素杂质是必须检测四大还是七大
获得FDA认证的程序
对于原料药来说,通过FDA批准主要有两个阶段:一是DMF文件的登记,要求递交的DMF文件对所申请的药品的生产和质量管理的全过程以及药品质量本身做一个详尽的描述。FDA要为此文件保密,该文件是由FDA的药物评价及研究中心(Center for Drug Evaluation and Research, CDER)来审核。二是当DMF文件的登记已经完成,而且在美国的原料药品终端用户提出了申请以后,FDA官员对原料药物的生产厂家进行GMP符合性现场检查,通过对药品生产全过程的生产管理和质量管理状况的全面考察,做出该原料药生产企业的生产和质量管理能否确保所生产药品的质量的判断。FDA在现场检查的基础上做出是否批准该原料药品在美国市场上市的决定。
其基本程序如下所示:
1.进行国际市场调研,摸清美国市场目前的销售情况,对市场发展趋势与走向做出正确的预测、分析和判断,选择好申请FDA批准的品种。
2.选择申请代理人和代理经销商,并签订委托协议书、签署委托书。
3.编写申请文件,原料药为DMF文件,由代理人完成申请文件终稿的编写并向FDA递交,取得DMF文件登记号。
4.FDA收到申请文件后,经初审合格后发通知函给申请人,并发给一个登记号,说明DMF文件持有人的责任和义务。
5.工厂按美国cGMP的要求进行厂房、设施设备的改造和并完善生产质量管理的各项软件和相关人员的强化培训。
6.应美国制剂生产厂家(即该原料药品的终端用户)的申请, FDA派官员到生产厂家按照FDA颁布的生产现场检查指南并对照已上报审核的DMF文件进行检查,FDA官员在生产现场的基础上出具书面意见给生产厂家并向FDA报告检查结果。
7.FDA审核批准后将审核结果通知生产厂家并输入美国海关的管理系统,该原料药品即获准直接进入美国市场。
8.生产厂家每年向FDA递交一份DMF修改材料,一般情况下, 每2~3年可能要接受一次复查。
194910月1华民共立党政府十关怀民医药卫保健工作11月卫部召集京关医药专家研讨编纂药典问题19501月卫部海调药专家孟目教授负责组建药典编纂委员处理工作干事筹划编制新药典19504月海召药典工作座谈讨论药典收载品种原则建议收载品种并根据卫部指示提新药典要结合情编部具民族化、科化、众化药典随卫部聘请药典委员49设名词、化药、制剂、植物药、物制品、物药、药理、剂量8组另聘请通讯委员35立第届药典编纂委员卫部部李德全任主任委员19514月24至28北京召第届药典编纂委员第全体议议药典名称、收载品种、专用名词、度量衡问题及格式排列等作决定干事根据全讨论意见药典草案进行修订草案于1952底报卫部核转政务院文教委员批准第部《药典》1953版由卫部编印发行1953版药典共收载药品531种其化药215种植物药与油脂类65种物药13种抗素2种物制品25种各类制剂211种药典版于1957版《药典》1953版第增补本1955卫部立第二届药典委员聘请委员49通讯委员68届委员故未能进行工作1957立第三届药典委员聘请委员80药专家汤腾汉教授届委员主任委员(设通讯委员)同7月28至8月5北京召第全体委员议卫部李德全部作药典工作报告特别指第版药典没收载广民习用药缺陷议总结工作基础通制订药典原则讨论药典性质作用并修改委员章程议致认应合乎条件药收载药典8月27卫部批准委员设药理与医、化药品、药剂、化药品、药、物制品六专门委员及名词组药典委员设务委员工作机构改称秘书室1958经务委员研究并经卫部批准增聘医专家8、药专家3组医药专门委员组织关省市医药专家根据传统医药理论经验起草药材药(即药)标准19596月25至7月5北京召届委员第二全体议议主要审议新版药典草稿并确定收载品种草稿经修订补充别由各专门委员审定于1962完送审稿报请务院批准付印19651月26卫部公布《药典》1963版并发通知施行1963版药典共收载药品1310种、二两部各凡例关附录部收载医用药材446种药制剂197种;二部收载化药品667种外部记载药品功能与主治二部增加药品作用与用途1966由于乱影响药典委员工作陷于停顿19724月28务院批复卫部同意恢复药典委员四部(卫部、燃料化工业部、商业部、解放军总卫部)参加卫部牵据同5月31至6月10北京召编制家新药典工作议席议全各省(自治区、直辖市)药品检验、药政管理及关单位代表共88议着重讨论编制药典指导思想、、任务要求交流工作经验确定编制新药典案并工落实起草任务19734月北京召第二全药典工作议讨论制订药典些原则要求及西药品标准稿起草说明书并根据药材主产药品产情况调整起草任务197910月4卫部颁布《药典》1977版自19801月1起执行1977版药典共收载药品1925种部收载草药材(包括少数民族药材)、草药提取物、植物油脂及些单味药材制剂等882种制剂(包括少数民族药)270种共1152种;二部收载化药品、物制品等773种1979由卫部聘请委员112组建第四届药典委员卫部部钱信忠兼任主任委员同11月22至28北京召届第全体委员议议讨论修改委员章程、药品标准工作管理及工作计划委员设:医、药、医与药理、化药、化药、药剂、抗素、物制品、放射品及名词10专业组由关专业组别推荐新药典收载品种医专业组负责审查拟定部收载品种范围;医与药理专业组负责审查拟定二部收载品种范围;由主产所省(自治区、直辖市)药品检验所关单位负责起草标准药典委员公室组织交叉复核些项目组专题协作组通实验研究起草标准草案经关专业组委员并邀请关药品检验所药厂代表讨论审议报卫部审批《药典》1985版于19859月版19864月1起执行该版药典共收载药品1489种部收载药材、植物油脂及单味制剂506种药207种共713种;二部收载化药品、物制品等776种19857月1《华民共药品管理》式执行该规定药品必须符合家药品标准或者省、自治区、直辖市药品标准明确务院卫行政部门颁布《华民共药典》药品标准家药品标准务院卫行政部门药典委员负责组织家药品标准制定修订进步确定药品标准定性质药典委员任务1986卫部根据药典委员章程聘请委员150组建第五届药典委员由卫部崔月犁部兼任主任委员设事机构改秘书制同5月5至8召第五届第全体委员议讨论修订委员章程通七五期间标准工作设想确定编制《药典》1990版指导思想原则要求别举行药材、药制剂、化药、抗素、化药及药理等专业议安排起草科研任务198711月版《药典》1985版增补本新增品种23种修订品种172种附录21项198810月第部英文版《药典》1985版式版同版药典二部注释选编19893月各起草1990版药典标准初稿基本完药典委员设机构始组织审稿编辑加工同12月北京举行药典委员主任委员、副主任委员各专业组扩议进行审议报卫部批准付印199012月3卫部颁布《药典》1990版自19917月1起执行版药典、二两部共收载品种1751种部收载784种其药材、植物油脂等509种药及单味制剂275种;二部收载化药品、物制品等967种与1985版药典收载品种相比部新增80种二部新增213种(含1985版药典部移入5种);删25种(部3种二部22种);药品名称根据实际情况作适修订药典二部品种项规定作用与用途用与用量别改类别剂量另组织编著《临床用药须知》书指导临床用药关品种红外光吸收图谱收入《药品红外光谱集》另行版该版药典附录内再刊印1991组建第六届药典委员由卫部聘请委员共168卫部陈敏章部兼任主任委员同5月16至18召第全体委员议讨论通委员章程编制《药典》1995版设计案并立由主任委员、副主任委员专家共11组务委员设13专业组即:医专业组、药材专业组、药专业组、西医专业组、药理专业组、化药专业组、化药专业二组、化药专业三组、抗素专业组、化药品专业组、物制品专业组、放射品专业组、药品名词专业组各专业组别召专业组委员扩议安排落实全提任务1993《药典》1995版附录初稿发往各作起草、修订文标准依据19947月各基本完标准起草任务由药典委员各专业委员别组织审稿工作199411月29提交务委员扩议讨论审议获原则通报请卫部审批付印卫部批准颁布《药典》1995版自19964月1起执行版药典收载品种共计2375种部收载920种其药材、植物油脂等522种药及单味制剂398种;二部收载1455种包括化药、抗素、化药、放射品、物制品及辅料等部新增品种142种二部新增品种499种二部药品外文名称改用英文名取消拉丁名;文名称收载药品定通用名称再列副名编制版《药品红外光谱集》第卷(1995版)《临床用药须知》书经修订随《药典》1995版同版经卫部批准其适应证剂量部作药政产部门宣传使用管理药品依据届药典委员除完1995版药典编制外于1992、1993先编制版《药典》1990版第、第二增补本二部注释部注释选编《药彩色图集》《药薄层色谱彩色图集》及《药品通用名称》等标准面配套丛书《药典》1990版英文版亦于19937月版发行19965月经卫部批准第七届药典委员立由卫部聘请204位委员组其名誉委员18卫部陈敏章部兼任主任委员19989月根据编(1998)32号文:卫部药典委员更名家药典委员并建制划转家药品监督管理局管理管理体制变化及19993月陈敏章部逝世征关领导部门同意按照第七届药典委员章程精神经199912月第七届药典委员务委员议致同意调整主任委员、副主任委员届委员设专业委员共16别:医专业委员、药第专业委员、药第二专业委员、药第三专业委员、药第四专业委员、医专业委员、药品名词专业委员、附录专业委员、制剂专业委员、药理专业委员、化药品第专业委员、化药品第二专业委员、抗素专业委员、化药品专业委员、放射品专业委员、物制品专业委员1996召第七届药典委员务委员第议通届药典委员提《药典》2000版设计案部确立突特色立足提高二部确立赶超与情相结合先进与特色相结合指导思想根据届委员提设计案199610月起各专业委员先召议落实设计案提任务并工进行工作1997底首先完附录与制剂通则修改并发各起草单位征求意见1998底药典初稿完经进步征求全各关面意见至199910月底先召16专业委员审定稿议《药典》 2000版于199912月经第七届药典委员务委员议审议通报请家药品监督管理局批准颁布于20001月版发行20007月1起式执行2000版药典共收载药品2691种其部收载992种二部收载1699种、二两部共新增品种399种修订品种562种版药典附录作较幅度改进提高部新增附录10修订附录31;二部新增附录27修订附录32二部附录首收载药品标准析验证要求等六项指导原则统、规范药品标准试验起指导作用现代析技术版药典进步扩应用第七届药典委员完《药典》1995版九九七增补本、九九八增补本、《药品通用名称》(九九八增补本)及《药品红外光谱集》(第二卷)、《临床用药须知》(第三版)1997完《药典》1995版英文版加强际合作与交流第七届药典委员决定《药典》2000版英文版与文版同步版往几版药典剂量、注意项内容由于于简单能准确反映临床用药实际情况根据《药典》2000版设计案提议版药典二部取消两项其关内容移至《药典》2000版《临床用药须知》书200210月经家食品药品监督管理局批准第八届药典委员立由家食品药品监督管理局聘请312位委员组再设立名誉委员原务委员更名执行委员由全体委员授权审定《药典》及家药品标准重事项本届委员设专业委员共24届委员基础增设民族药专业委员(筹)、微物专业委员、药品包装材料与辅料专业委员;原物制品专业委员扩增血液制品专业委员、病毒制品专业委员、细菌制品专业委员、体细胞治疗与基治疗专业委员、重组制品专业委员体外诊断用物试剂专业委员200210月召第八届药典委员全体及执行委员第议通本届药典委员提《药典》2005版设计案设计案明确坚持继承与发展、理论与实际相结合针;确定科、实用、规范等药典编纂原则;决定《物制品规程》并入药典设药典三部;并编制首部药《临床用药须知》200211月起各专业委员先召议安排设计案提任务并别进行工作20037月首先完附录草案并发关单位征求意见2004初药典附录与品种初稿基本完增修订内容陆续家药典委员网站公示3月征求全各关面意见6月至8月各专业委员相继召审定稿议9月《药典》2005版经第八届药典委员执行委员议审议通12月报请家食品药品监督管理局批准颁布于20051月版发行20057月1起式执行本版药典收载品种较幅度增加共收载3212种其新增525种药典部收载品种1147种其新增154种、修订453种;药典二部收载1964种其新增327种、修订522种;药典三部收载101种其新增44种、修订57种《药典》2000版收载本版药典未收载品种共9种;2000版《物制品规程》及2002增补本收载未收载入药典品种共123种本版药典收载附录药典部98其新增12、修订48删除1;药典二部137其新增13、修订65、删除1;药典三部140其新增62、修订78删除1、二、三部共同采用附录别各部予收载并进行协调统本版药典主任委员积极倡导药品安全性问题更加重视药典部采用原吸收电耦合等离体质谱增加害元素(铅、镉、砷、汞、铜)测定并规定害元素限度;药典部增加药注射剂安全性检查应用指导原则药典二部126静脉注射剂增订溶性微粒检查增修订细菌内毒素检查品种达112种;残留溶剂测定引入际间已协调统关残留溶剂限度要求并24种原料药增订残留溶剂检查;药典二部增加药品杂质析指导原则、电类锝[99mTc]放射品质量控制指导原则药典三部增订逆转录酶性检查、血白蛋白铝残留量测定等牛血清白蛋白残留量及CHO细胞蛋白残留量等检测改进本版药典结合我医药工业现状临床用药实际情况由卫部颁布原《澄明度检查细则判断标准》修订见异物检查加强注射剂等药品用药安全本版药典坚持注重环保贯性原则品种苯等害溶剂尽能采用其溶剂替代本版药典根据医辨证施治理论收载药标准项功能主治进行科规范准确理解药功能主治及合理用药提供保证促进医药新期健康发展本版药典三部源于《物制品规程》自1951该规程已六版颁布执行别1951及1952修订版、1959版、1979版、1990版及1993版(诊断制品类)、1995版、2000版及2002增补版2002翻译版第部英文版《物制品规程》(2000版)第八届药典委员完《药典》2000版2002增补版、2004增补版、《药品通用名称》(2005版)及《药品红外光谱集》(第三卷)、《临床用药须知》(药第版、化药第四版)2005完《药典》2005版英文版加强际合作与交流本届委员期间与美药典委员联合举首届美药典论坛2011版《药典》部、二部三部收载品种总计4567种其新增1386种药典部收载药材饮片、植物油脂提取物、制剂单味制剂等品种共计2165种其新增1019种(包括439饮片标准)、修订634种;药典二部收载化药品、抗素、化药品、放射品及药用辅料等品种共计2271种其新增330种、修订1500种;药典三部收载物制品品种共计131种其新增37种、修订94种2011版药典收载附录亦变化其药典部新增14、修订47;药典二部新增15、修订69;药典三部新增18、修订39、二、三部共同采用附录别各部予收载并尽能做统协调、求同存异2015版《药典》新立第10版药典20113月第十届药典委员组建立历5完新版药典编制工作2015版《药典》收载品种总数达5608比2011版药典新增1082涵盖基本药物、医疗保险目录品种临床用药品更加适合于临床用药需求且标准数量全面提升特别围绕安全性效性控制项目增加检测项目《药典》于201512月1起式实施家食品药品监督管理总局科技标准司司于军介绍《药典》家保证药品质量控、确保民用药安全效依制定药品典药品研制、产、经营、使用管理都必须严格遵守定依据家药品标准体系核于军表示2015版《药典》历版药典基础坚持保障公众用药安全原则品种收载、检验完善、检测限度设定及质量控制水平都较提升重点加强药品安全性效性控制要求充借鉴际先进质量控制技术经验整体提升药典标准水平全面反映我前医药发展检测技术水平集体现前我药典标准新科研推我药品质量提高、加快企业技术进步产品升级换代、促进我医药产业结构调整、提升《药典》权威性际影响力等面发挥重要作用2015版《药典》收载品种总数达5608比2011版药典新增1082本版《药典》重要变化部、二部、三部附录进行整合增设药典第四部使《药典》类更加清晰明确新版《药典》发布总局重点展新版药典宣传培训工作培训工作计划已制定完药典委计划、针性组织药典委员专家新版《药典》技术要求、质量控制理念等面展培训使众药品产经营企业、药品检验机构及其药典使用单位员充解掌握新版《药典》主要变化技术要求确保新版《药典》顺利实施于军强调请采纳感觉提问主意不是很清晰建议查下资料哦
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。