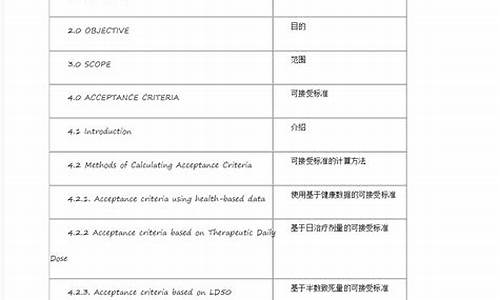
原料药生产的关键工序是指原料药的什么-原料药关键生产工艺风险评估报告最新版
行不行不是嘴巴说说就行,而是要进行风险评估。比如你的产品虽然专线,但是微生物限度要不要控制,只是做目视洁净能不能保证清洁方法能控制微生物。再比如,你的原料会不会降解,进而影响下批产品。这些都要评估,都要数据证明呀。法规是明确说了要清洁验证,可没说共线不用做,既然你要选择简略版的清洁验证,那就要有能力说服检查员,否则必定又是一个缺陷。
三种方法中,选择限度最低的那种。如果是多品种生产,同样的清洁方法,也是这样选择,作为标记化合物进行清洁验证。
一般是选择合适的浓度。
第一种,不然计算共用面积干嘛。
TOC适合。
原料药注册申报流程
原料药投产安全先要办的手续有:
1、安全生产许可证申请:申请单位需向当地安全生产监管部门提交申请材料,包括企业基本情况、生产工艺流程、安全管理制度等,经审核符合要求后颁发安全生产许可证。
2、环境影响评价:根据国家环境保护法规定,投产前需要进行环境影响评价,评估项目对环境的影响程度,制定环境保护措施。
3、安全评估:对生产过程中可能存在的安全风险进行评估,制定相应的安全管理措施,确保生产过程中的安全。
流程:
1、注册申报取得相应批准文号。
2、与制剂相关联审评:药政改革,与制剂关联审评审批,状态由“I”转“A”。
一、具体流程
1.登记资料要求
- 申请人在完成上市注册的药学研究、商业规模的工艺验证、确定质量标准,做好药品注册核查检验的准备后,提交API登记资料;
- 按照《M4:人用药物注册申请通用技术文档(CTD)》的要求,整理申报资料;
- 以光盘为载体,递交电子版申报资料。
2.CDE开展形式审查
- 申报资料不符合要求的,CDE会在5日内告知申请人需补正的内容,申请人必须在30日内完成补正;
- 申报资料符合要求后,CDE会发出受理通知书、缴费通知书、注册检验通知书,并在CDE原辅包公示平台公示该产品,其状态为“I”。
3.申请人缴费
- 申请受理后,申请人必须在15日内缴纳注册费,申请人缴费时间以国家药监局收到汇款日期为准;
- 未按要求缴费的,CDE会终止注册审评审批;申请人需申请撤销原登记号后,再次递交新的注册申请。
- 原料药缴费标准见附表。
4.CDE开展技术审评
- 注册申请受理和缴费后,CDE会开展技术审评;
- 需补充资料的,CDE会在200日内告知申请人补充要求,申请人必须在80日内提交补充资料
5.药品注册检验
- 注册检验包括标准复核和样品检验。标准复核是评估质量标准的科学性和合理性;样品检验是对样品的实验室检验;
- 与国家药品标准收载的同品种药品使用相同检验项目和方法的,可只进行样品检验。反之应进行标准复核和样品检验。其中样品检验的工作时限为60日,样品检验和标准复核为90日;
- 对于国产原料药,由申请人或生产企业所在地省级药品检验机构承担;对于境外生产的原料药,由中检院组织口岸药品检验机构实施;
- 申请人在收到注册检验通知书后,应在30日内向中检院或省级药品检测机构提出注册检验申请,并提交相关资料。
6.药品注册核查
- 药品注册核查是指为核实申报资料的真实性、一致性以及药品上市商业化生产条件,对研制现场和生产现场开展的核查活动;
- CDE根据药物创新程度、药物研究机构既往接受核查情况,基于风险决定是否开展注册核查;
- 药品核查中心原则上按照已受理申报资料中的生产工艺和质量标准开展注册核查;
- 注册核查的工作时限原则上为120日。
7.CDE开展综合审评
- CDE在收到申请人的补充资料、中检院的注册检验复核意见、药品核查中心的核查结果(如有)后,启动综合审评,审评时限延长三分之一;
- 在该过程中,CDE会与申请人核准生产工艺、质量标准和标签。
8.CDE审批决定
- 审批未通过的,CDE发出化学原料药不予批准通知书,原辅包公示平台中的状态(I)保持不变;
- 审批通过的,CDE发出化学原料药批准通知书及核准后的生产工艺、质量标准和标签,并在原辅包公示平台更新状态,将“I”变为“A”。
9.其他说明
- 申请人应当为能够承担相应法律责任的企业或者药品研制机构等;
- 境外申请人应当指定中国境内的企业法人办理相关药品注册事项;
- 申报流程中规定的期限皆以工作日计算。
法律依据:
《中华人民共和国药品管理法》
第七条:从事药品研制、生产、经营、使用活动,应当遵守法律、法规、规章、标准和规范,保证全过程信息真实、准确、完整和可追溯。
第八条:药品监督管理部门主管全国药品监督管理工作。有关部门在各自职责范围内负责与药品有关的监督管理工作。药品监督管理部门配合有关部门,执行国家药品行业发展规划和产业政策。
省、自治区、直辖市人民政府药品监督管理部门负责本行政区域内的药品监督管理工作。设区的市级、县级人民政府承担药品监督管理职责的部门(以下称药品监督管理部门)负责本行政区域内的药品监督管理工作。县级以上地方人民政府有关部门在各自职责范围内负责与药品有关的监督管理工作。
第十一条:药品监督管理部门设置或者指定的药品专业技术机构,承担依法实施药品监督管理所需的审评、检验、核查、监测与评价等工作。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。