原料药 出口-原料药出口报告
进口药品注册管理办法及所需时间 1、申请进口药品注册,应当填写《药品注册申请表》,报送有关资料和样品,提供相关证明文件,(证明性文件需向进口国的大使馆进行公证)向国家食品药品监督管理局提出申请。 2、国家食品药品监督管理局对申报资料进行形式审查需30日,符合要求的,出具药品注册申请受理通知书并通知中国药品生物制品检定所组织对3个生产批号的样品进行注册检验。 3、中国药品生物制品检定所收到资料和样品后,应当在5日内组织进行注册检验。 4、承担进口药品注册检验的药品检验所在收到资料、样品和有关标准物质后,应当在60日内完成注册检验并将药品注册检验报告报送中国药品生物制品检定所。特殊药品和疫苗类制品的样品检验和药品标准复核应当在90日内完成。 5、中国药品生物制品检定所接到药品注册检验报告和已经复核的进口药品标准后,应当在20日内组织专家进行技术审查,必要时可以根据审查意见进行再复核。 6、国家食品药品监督管理局药品审评中心应当在120日内组织药学、医学及其他技术人员对申报资料进行审评,如需补充资料,审评中心发布补充资料通知,根据通知内容,需在4个月内一次性将资料补充完毕。药品审评中心对补充资料进行审评需40日。 7、国家食品药品监督管理局应当在20日内作出审批决定;20日内不能作出决定的,经主管局领导批准,可以延长10日,并应当将延长时限的理由告知申请人。 8、国家食品药品监督管理局应当自作出药品注册审批决定之日起10日内颁发、送达有关行政许可证件。 9、申请人拿到临床批件需向国家食品药品监督管理局提交临床方案等资料进行备案,然后进行临床试验6-8个月。 10、将临床报告递交国家食品药品监督管理局。国家食品药品监督管理局药品审评中心应当在120日内组织药学、医学及其他技术人员对报送的临床试验等资料进行全面审评。如需补充资料,审评中心发布补充资料通知,根据通知内容,需在4个月内一次性将资料补充完毕。药品审评中心对补充资料进行审评需40日。 11、国家食品药品监督管理局依据综合意见,在20日内做出审批决定。符合规定的,发给《进口药品注册证》。 综上所有手续,共需受理时间为:23-38个月
土耳其原料药出口注册流程
这个没什么特别的呀。
那0.6%不一定就是杂质。要知道原料药可能影响主成分的物质很多,比如:水分、氯化物、重金属、残留溶剂、炽灼残渣。
简单地说,原料药如果容易吸潮,水分多一点就足够弥补了。
原料药和新制剂中的杂质,哪些需要对其定性或结构确证
土耳其原料药出口注册流程
原料药是我国医药产业参与国际竞争的优势长板,新冠疫情发生以来,全球医药产业链受到冲击,使得我国原料药产业的战略地位进一步提升。据国家发改委统计,我国几乎可以生产全部品种的原料药,种类高达1500多种,其中60%产量用于出口。截止到2019年,我国原料药共出口到189个国家和地区,主要集中于亚洲、欧洲和北美洲三大市场,国际认证是出口必不可少的一道手续。原料药出口需要递交大量的产品相关资料给当地政府或相关机构获得认证后才能出口,如果不是相同语言的国家出口原料药,所递交的资料和各类说明文件还要进行翻译。原料药认证所需的相关资料对格式要求非常严格,并且专业术语多、难度大。
原料药认证翻译拥有以下资质能更快更好地获得认证:
翻译人员是药学或医学相关专业
熟悉各国的认证流程和相关政策
熟悉认证资料格式和相关术语
国际上常见的三种原料药认证分别为美国的FDA认证、欧洲EDQM认证和日本PMDA认证
FDA认证
美国FDA认证分为五类:I型-生产地点和厂房设施、II型-中间体、原料药和药品、III-型包装物料、IV-型辅料、着色剂、香料、香精及其他添加剂、V-型非临床数据资料和临床数据资料
一般情况下中国厂商的申报认证程序如下:
显示所有大图
EDQA认证
欧洲的CEP 只适用于已有《欧洲药典》( EP) 标准的原料,即 EP 收载的原料药品种。
申请CEP的基本程序包括:
PMDA认证
日本的PMDA认证只能通过日本国内的管理人将MF申请递交给PMDA官方,不能由自己直接递交。
申请MF的基本程序包括:
无论是哪一个国家的申请都离不开CTD文件、GMP检验报告、官方提出的修改意见及问题和补充文件及回复说明。各国文化背景的不同使语言成为了横亘在中间最急需攻克的难题。
国家
修改意见及问题
补充文件及回复说明
美国
483表问题
现场检查及483表的回复说明
欧洲
EDQM提出的修改意见
GMP检查的回复补充说明
日本
PMDA提出的缺陷问题
对PMDA提出的缺陷进行回复
CTD的排版要求
CTD中信息的表达要明确、清楚,申请人不应修改CTD的整体结构,以利于审查内容和快速查找。
纸张大小:欧洲和日本-A4,美国letter纸(8.5X11``)文档和表格应留出余地,以方便在纸张上打印。左手边空白部分应保证装订不受影响
字体:文档和表格的字符大小应足以清楚阅读,建议描述性文档采用Time New Roman,12的字符。
缩写词应在每模块中第一次使用时进行定义。
每页必须有编号页码。
美国DMF文件M1要求
CUVER LETTER(首页)
STATAMENT OF COMMITMENT(声明信)
Administrative Page(行政信息)
US Aent Appointment Letter(美国代理人的指定)
Letter of Authorization(授权信)
Holder Name Transfer Letter(证书持有人转移)
New Holder Acceptance Leeter(新持有人接受函)
REQUEST TO(WITHDRAW,CLOSE) a DMF(DMF的取消与关闭)
Paten satement(专利声明)
欧洲CEP申请文件M1要求
申请表
letter ofAuthorisation(授权信)
declaration in cases where the manufacturer is not the intended holder of a Certificate of Suitability(证书持有人与生产厂商不同的声明信)
letter of declaration of willingness to be inspected(愿意接受检查声明)
letter of declaration of substances of animal/human origin(TSE风险的声明)
letter of commitment to provide samples upon requert by the EDQM(愿意提供样品的声明
模块M2:质量综述
项目
2.3.S.1基本信息
2.3.S.1.1药品名称
2.3.S.1.2结构
2.3.S.1.3理化物质
2.3.S.2生产信息
2.3.S.2.1生产商
2.3.S.2.2生产工艺和过程制作
2.3.S.2.3物料控制
2.3.S.2.4关键步骤和中间体控制
2.3.S.2.5工艺验证和评价
2.3.S.2.6生产工艺的开发
2.3.S.3结构确证
2.3.S.3.1结构和理化性质
2.3.S.3.2杂质
2.3.S.4原料药的控制
2.3.S.4.1质量标准
2.3.S.4.2分析方法
2.3.S.4.3分析方法的验证
2.3.S.4.4批检验报告
2.3.S.4.5质量标准制定依据
2.3.S.5对照品
2.3.S.6包装材料和容器
2.3.S.7稳定性
2.3.S.7.1稳定性总结
2.3.S.7.2上市稳定性承诺和稳定性方案
2.3.S.7.3稳定性数据总结
模块M3: 质量部分
项目
3.1目录
3.2.S原料药
3.2.S.1一般信息
3.2.S.1.1命名
3.2.S.1.2化学结构
3.2.S.1.3一般特性
3.2.S.2生产
3.2.S.2.1生产商
3.2.S.2.2生产工艺和过程控制的描述
3.2.S.2.3物料控制
3.2.S.2.4关键工艺步骤和中间体的控制
3.2.S.2.5工艺验证
3.2.S.2.6生产工艺的改进与变更控制
3.2.S.3结构表征
3.2.S.3.1结构表征和其他特性
3.2.S.3.2杂质
3.2.S.4原料药控制
3.2.S.4.1质量标准
3.2.S.4.2分析方法
3.2.S.4.3分析方法验证
3.2.S.4.4批分析报告
3.2.S.4.5质量标准合理性分析
3.2.S.5对照品
3.2.S.6包装容器和密封方式
3.2.S.7稳定性实验
3.2.S.7.1稳定性实验概述和结论
3.2.S.7.2申请批准后的稳定性实验方案和稳定性保证
3.2.S.7.3稳定性实验结果列表
雅瑞思医学翻译一直专注于医药、医疗器械领域翻译,拥有上百名药学、医学、物理学、生物学、制造学、工程学专职翻译专家。医药翻译部由药理学、毒理学、生药学、药物化学、药物分析学、药剂学、临床医学、临床药理学背景的专业翻译人员组成,都曾在药厂或者大学药学院工作、学习过,对原料药DMF、IND、AND的全套文件翻译极为熟悉,多数成员都具备医学或者药学硕士及以上文凭。
进口中药材,中药饮片、原料药应具有哪些证书和批件?
原料药是原料药,制剂是制剂。你知道这些杂质是原料药中带入的,只能证明了它的来源。现在对于杂质的要求非常严格,即便是原料药中的杂质也分为:起始物料、中间体或者降解产物等等。
看这个吧,超过了报告限度的杂质,是需要出报告的。超过鉴定限度的杂质是需要知道它具体的化学结构的。
尤其是你在制剂研究、生产过程中监控这些杂质的增长情况。有些杂质在原料药里增长不明显,做成了制剂就蹭蹭地长。到底是湿度影响,还是酸碱度影响,或者是温度影响。这关系到制剂工艺的问题,另外产品贮藏条件,包装条件都是跟主成分含量以及杂质有关系的。,具体的可以查询药智网,回答满意请您采纳,谢谢。
api的原料药的发展
进口原料药、中药材、中药饮片应具有《进口药品注册证》(或《医药产品注册证》)或《进口药品批件》,应符合药品进口手续,应有口岸药品检验所的药品检验报告。进口药品注册证》或《医药产品注册证》、《进口药品检验报告书》或《进口药品通关单》和首次进口的《进口药品检验报告单》。
2.进口药材:《进口药材批件》。
3.《注册证》、《批件》的有效期、生产国、进口包装的标签上应注明药品的名称、注册证号,并有中文标识。
4.复印件应有供货单位质量管理机构的原印章。
5.所规定的范围内,需批批进口检验的,应按规定索要批《进口药品检验报告
6.相关的管理文件。
根据权威调查机构发布的国内化学药制品市场分析报告指出,2013年化学制药工业经济运行情况不容乐观,但增长情况仍值得期待。创新型企业将带动本产业转型升级。此外,随着化学制药工业电子务的发展,入驻交易平台成为创新型企业的必经之路。传统的原料药发展受限,转型升级需择路而行,随着深圳创新型企业入驻南方交易平台,越来越多的原料药供应商也开始了自己的电商之路。 中国是原料药生产大国,2012年原料药产量为136万吨,同比增长了9.05%,产量位居世界第一。规模效益的取得得益于中国生产的低成本和环境的污染,在目前我国物价普遍上涨,环保管理不断加强的情况下,行业发展的成本优势变的不明显。
在国际上,中国最大的竞争对手印度,虽然其在行业发展的规模上不如中国,但在成本优势和行业发展速度上都比中国有明显的优势。 我国现有医药企业8700多家,通过GMP的医药生产企业6000多家,在国家食品药品监督管理局注册的原料药生产企业共有3000多家,医药中间体的生产企业也占较大比例,
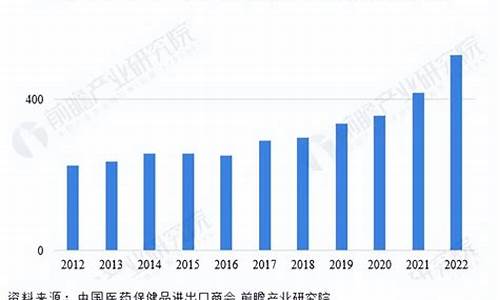
2008年,中国原料药进出口总额238.94亿美元,同比增长22.19%,占我医药进出口总额的49.07%。
从2008年至今,我国原料药出口年均复合增长率超过20%,2009出口额达到175.8亿美元,同比增长29.59%。出口对原料药工业的拉动作用越来越明显和重要,直接促进了行业利润水平的提高,2012年1-11月,原料药实现利润155.9亿元,增幅高达49.5%。 第一,受金融危机的影响,国际买家资金紧张,购买力下降或购买周期延长,不仅影响了中国原料药的销售量,而且增大了出口企业的经营风险。
第二,价格暴涨暴落加重了国际买家的担心和观望,影响了原料药行情的平稳发展。
第三,部分原料药价格增幅较大,造成企业扩大产能的冲动,加剧了市场供过于求的矛盾。
第四,主要出口目的国和竞争对手国的货币贬值,降低了中国原料药的价格竞争力,加大了出口难度。第五,金融危机促使国际贸易保护主义加剧,使中国部分出口市场环境进一步恶化。 首先,全球药品市场2014年将有望保持8%以上的增幅,新兴医药市场有可能保持更大的增幅,原料药的国际国内市场需求将继续呈增长态势。
其次,中国的许多原料药品种在国际市场占有较高的市场份额,规模优势明显,短期内其它国家无法替代。
第三,虽然因多重因素的影响,中国原料药的价格有较大上涨,但这些上涨因素是刚性的,2013年不可能大幅下降并影响到中国原料药的出口总额。从2012年原料药进口情况看,均价上涨了28.21%,在全球原料药价格普遍上涨的情况下,中国原料药价格的比较优势依然存在。
第四,中国企业避免同质化竞争,发展特色原料药的努力,和众多企业瞄准发达国家市场,积极通过高端市场认证,不断提高出口产品质量的做法,将拓展中国原料药的出口空间。
第五,国家鼓励出口政策的不断出台和落实,也将对原料药的出口增长起到重要的推动作用。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。