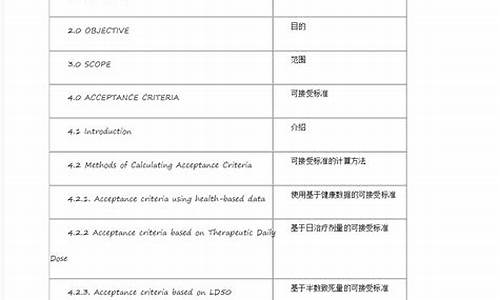
原料药含量计算公式表-原料药的含量计算公式

准备报考2018年执业药师的广大考生们请关注了,为你整理了<2018年执业药师《专业知识一》基础试题及答案(5)>,更多有关执业药师资讯,网站将持续更新,敬请关注!
2018年执业药师《专业知识一》基础试题及答案(5)
一、最佳选择题
1、在中国药典中,收载“通用检测方法”的部分是
A、附录 B、目录 C、索引 D、凡例 E、正文
正确答案 A
答案解析《中国药典》由凡例、正文、附录组成。其中,凡例是解释和使用《中国药典》、正确进行质量检定的基本原则,“凡例”把与正文品种、附录及质量检定有关的共性问题加以规定,有关规定具有法定的约束力;正文收载了不同药品、制剂的质量标准;附录的主要内容为制剂通则、生物制品通则、通用检测方法、生物检定法、试药和试纸、溶液配制、原子量等。因此收载“通用检测方法”的部分是附录。
2、下列属于偶然误差的是
A、方法误差 B、仪器误差 C、试剂误差 D、操作误差 E、温度误差
正确答案 E
答案解析根据误差的来源,系统误差可分为方法误差、仪器误差、试剂误差以及操作误差等。实验室温度、湿度等的变化造成的误差属于偶然误差。
3、用酸度计测定溶液的酸度,若溶液的pH为4.5左右,对酸度计进行校正时需选用的标准缓冲液是
A、磷酸盐标准缓冲液(pH6.86) B、邻苯二甲酸氢钾标准缓冲液(pH4.00)
C、磷酸盐标准缓冲液(pH6.86)和硼砂标准缓冲液(pH9.18)
D、草酸三氢钾标准缓冲液(pH1.68)和磷酸盐标准缓冲液(pH6.86)
E、邻苯二甲酸氢钾标准缓冲液(pH4.00)和磷酸盐标准缓冲液(pH6.86)
正确答案 E
答案解析测定前,按各品种项下的规定,选择两种pH值约相差3个pH单位的标准缓冲液,并供试液的pH值处于二者之间。
4、用氢氧化钠滴定液(0.1000mol/L)滴定20.00ml盐酸溶液(0.1000mol/L),滴定突跃范围的pH值是
A、3.00~4.00 B、3.00~4.30 C、4.30~9.70 D、8.00~9.70 E、9.70~10.00
正确答案 C
答案解析滴定突跃是选择指示剂的重要依据,凡是变色范围全部或部分区域落在滴定突跃范围内的指示剂都可用来指示滴定的终点。本滴定突跃范围为pH4.30-9.70,可选酚酞、甲基红、甲基橙等作指示剂。
5、非水碱量法测定有机碱的氢卤酸盐时,加入何种试剂消除氢卤酸的干扰
A、氯化铵 B、醋酸汞 C、硝酸银 D、醋酸钡 E、碘化钾
正确答案 B
答案解析由于氢卤酸的酸性较强,使滴定反应进行不完全。因此,在用高氯酸滴定液滴定之前,有时应先加入醋酸汞试液3-5ml,使形成难电离的卤化汞,以消除氢卤酸对测定的干扰,然后再用高氯酸滴定液进行滴定。
6、采用紫外分光光度法测定某药物的含量时,在300nm处测得供试品溶液的吸光度为0.638,已知该药物在300nm处的吸收系数为319,则供试品溶液的浓度为
A、0.002g/ml B、0.005g/100ml C、0.002g/100ml D、0.005g/ml E、0.02g/100ml
正确答案 C
答案解析依据Beer-Lambert定律,溶液浓度的计算公式为:c=A/El,式中溶液层厚度通常为1cm,所以,溶液的浓度为0.002g/100ml。这里要注意的是,计算结果单位是g/100ml。
7、用HPLC法测得某药保留时间为11.52分钟,半峰宽为3.0mm(纸速为5mm/min),其理论板数为
A、735 B、265 C、106 D、2042 E、2402
正确答案 D
答案解析本题依据公式:n=5.54(tR/W h/2 )2
本题中tR=11.52min;半峰宽W h/2需要换算单位:3.0/5=0.6min,单位与保留时间一致;代入上述公式即可得出结果。
8、尿液的PH一般在
A、2.8-4 B、3.8-5 C、4.8-8 D、5.8-9 E、7.8-10
正确答案 C
答案解析健康成人一日排尿量为1~5L,尿液的pH值在4.8~8.0之间。尿液的主要成分是水、含氮化合物(其中大部分是尿素)及盐类。
9、检查某药物中的重金属,称取样品1.0g,依法检查,与标准铅溶液(10μg/ml)1.0ml在相同条件下制成的对照溶液比较,不得更深。重金属的限量为
A、0.01% B、0.1% C、百分之一 D、百万分之十 E、百万分之二十
正确答案 D
答案解析注意:单位换算要将1.0g换算成106μg,代入公式得:(10μg/ml)×1ml/106μg求的百万分之十。
10、《中国药典》(2010年版)规定阿司匹林中所含水杨酸杂质的限量是
A、1.0% B、10% C、0.1% D、0.001% E、0.01%
正确答案 C
答案解析本题考点是《中国药典》(2010年版)规定阿司匹林中的特殊杂质水杨酸的限量是0.1%。
11、《中国药典》规定检查苯巴比妥的乙醇溶液的澄清度,其目的是
A、控制中间体 B、控制副产物 C、检查其溶出度 D、检查其溶解度 E、控制苯巴比妥酸盐杂质
正确答案 E
答案解析乙醇溶液的澄清度:苯巴比妥酸盐杂质在乙醇溶液中溶解度小,而主成分苯巴比妥溶解度大,据此可通过检查乙醇溶液的澄清度来检查苯巴比妥酸盐杂质。方法:取供试品1.0g,加乙醇5ml,加热回流3分钟,溶液应澄清。
12、2010年版《中国药典》规定的测定盐酸利多卡因含量的方法为
A、GC法 B、HPLC法 C、UV法 D、非水碱量法 E、氧化还原法
正确答案 B
答案解析《中国药典》(2010年版)收载的盐酸利多卡因的含量测定方法为HPLC法。
13、结构中具有酰肼基,可发生与氨制硝酸银试液的反应的是
A、异烟肼 B、巴比妥类 C、硝苯地平 D、对乙酰氨基酚 E、盐酸利多卡因
正确答案 A
答案解析与氨制硝酸银试液的反应:异烟肼的酰肼基具有还原性,可与硝酸银试液发生反应,将硝酸银中的Ag+还原成单质银。
14、生物碱盐酸盐的含量测定一般选用
A、NaNO2滴定法 B、HPLC法 C、紫外-可见分光光度法 D、非水碱量法 E、NMR法
正确答案 D
答案解析生物碱含有碱性,弱碱性,所以《中国药典》一般采用非水溶液滴定法测定原料药的含量。
15、醋酸地塞米松中“其他甾体”特殊杂质的检查方法应为
A、GC法 B、NMR法 C、HPLC法 D、TLC法 E、UV法
正确答案 C
答案解析醋酸地塞米松中的有关物质主要为结构类似的其他甾体,《中国药典》采用高效液相色谱法进行检查,色谱条件与含量测定项下的相同。
16、关于维生素B1的理化性质叙述正确的是
A、紫外吸收、旋光性 B、脂溶性、硫色素反应 C、水溶性、季铵结构 D、脂溶性、旋光性
E、水溶性、旋光性
正确答案 C
答案解析维生素B1又称盐酸硫胺,是由氨基嘧啶环和噻唑环通过亚甲基连接而成的季铵化合物,噻唑环上季铵氮原子及嘧啶环上氮原子均具有碱性,药用品为盐酸盐。维生素B1在水中易溶,在乙醇中微溶,在中不溶。维生素B1具有紫外吸收,其盐酸溶液的最大吸收波长为246nm。
药品差比价规则的药品差比价规则
1、首先根据客户的需求以及销售合同等文档中的约定,确定客户订购的原料药数量。
2、其次查询原料药的产品说明书或询问生产厂家,获得单个原料药包装的重量和数量信息。
3、最后使用批发数量=客户订单量/单个原料药的包装规格的公式计算原料药的批发数量即可。
万通702阳离子0.004n滴定液的标定
第一条 为规范政府制定药品价格的行为,提高药品价格决策的科学性和透明度,制定本规则。
第二条 本规则适用于政府定价、政府指导价药品。
第三条 本规则所称药品差比价,是指药品因剂型、规格或包装等不同而形成的价格之间的差额或比值。具体包括剂型差比价、规格差比价和包装差比价等。
第四条 确定药品差比价关系考虑的主要因素为社会平均成本、临床应用效果、治疗费用、生产技术水平、使用方便程度和产业发展方向等。
第五条 同种药品不同剂型规格品,应当以代表品价格为基础,按照规定的药品差比价关系制定价格。
第六条 确定代表品应当先确定代表剂型,再从代表剂型中确定代表规格。
(一)代表剂型按照以下方法确定:
口服固体制剂以普通片剂为代表剂型,无普通片剂的以普通硬胶囊剂为代表剂型;注射剂以小容量注射液为代表剂型,无小容量注射液的以普通粉针为代表剂型。同种药品无上述剂型的,以中国药典收录的剂型或原料药国家标准包含的剂型为代表剂型。
中国药典或原料药国家标准同时涉及多个剂型或均未收录的,以首先上市并仍正常生产和销售的剂型为代表剂型。
(二)代表规格按照以下方法确定:
已批准上市的规格中,以含量或装量与常用单次剂量相匹配、包装数量居中的规格作为代表规格。
(三)上述方法不能涵盖的,应综合考虑以下因素确定代表品:
1、临床常用。选择与药品主要适应症或功能主治相匹配,临床应用时间长,多家企业生产的剂型、规格。
2、国际通用。选择与国际市场主流剂型相匹配的剂型。
3、价格合理。选择市场实际购销价格比较合理,有利于理顺差比价关系的剂型、规格。
第七条 本规则所称剂型差比价,是指同种药品不同剂型之间的价格差额或比值。具体见附件一和附件二。
第八条 本规则所称规格差比价,是指同种药品同一剂型不同规格之间的价格差额或比值。具体包括含量差比价和装量差比价。
第九条 含量差比价。
药品标示的含量与日治疗量存在明确比例关系的,适用含量差比价。
其他条件相同时,非代表品价格=代表品价格×含量比价值。含量比价值计算公式为:K=alog2X (K=比价值,X=非2
代表品含量÷代表品含量,a=含量比价系数)。
含量比价系数最高为 1.7。
葡萄糖、氯化钠等调节电解质类大容量注射液含量有差异的,不区分价格。组方相同用途相同而配比不同的化学药品复方制剂,按照各组分含量之和计算含量差比价。
第十条 装量差比价。
药品标示的装量与日治疗量存在明确比例关系的,适用装量差比价。
其他条件相同时,非代表品价格=代表品价格×装量比价值。装量比价值计算公式为:K=1.9log2X (K=比价值,X=非代表品最小独立包装装量÷代表品最小独立包装装量)。
不同装量的化学药品和生物制品注射液,10ml(含10ml)以下的,不区分价格;10ml 以上的,每增(减)10ml,加(减)
0.05 元。
第十一条 同种药品相同剂型标示的含量、装量与日治疗量均没有明确比例关系的,不适用含量差比价和装量差比价,应按照日平均治疗费用相同的原则计算价格。计算公式为:非代表品最小计量单位价格=代表品最小计量单位价格×代表品日治疗量÷非代表品日治疗量。
第十二条 本规则所称包装差比价,是指同种药品相同剂型、规格中,不同包装数量、材料或形式之间的价格差额或比值,具体包括包装数量差比价、包装材料差比价和包装形式差比价。
第十三条 包装数量差比价。口服片剂、口服胶囊剂最小零售包装价格按以下方法计算:
其他条件相同时,非代表品价格=代表品价格×包装数量比价值。包装数量比价值计算公式为:K=1.95log2X (K=比价值,X=非代表品包装数量÷代表品包装数量)。用于慢治疗、需要长期使用的药品,按主要适应症或功能主治的成人单次最高剂量计算,包装数量不足三日(含三日)用药量的,按包装数量差比价计算后,再乘0.9 的缩减系数制定价格。
其他类别的剂型,最小零售包装价格按最小独立包装或最小计量单位的价格乘以包装数量计算。
第十四条 包装材料差比价。
(一)口服固体制剂,容器类型和包装材料不同的,不区分价格。
(二)生物制品小容量注射液采用预充式注射器包装单次剂量药品的,其他条件相同时,可在普通小容量注射液基础上最高加3 元。化学药品、中成药和天然药采用上述包装形式的,不区分价格。
(三)大容量注射液,以同规格玻璃瓶包装的价格为基础,塑料瓶包装最高加1 元;软袋(指在不通空气情况下完成输液的包装)最高加4 元。玻璃瓶、塑料瓶和软袋包装各自采用的具体形式和材料有差异的,不区分价格。
第十五条 包装形式差比价。
多种药品构成的组合包装(包括各药品独立包装的组合形式和各药品复合包装的组合形式),价格不高于所包装药品价格的总和。
药品与注射用溶媒、注射器等附件构成组合包装的,不区分价格。
第十六条 多种差比价混合计算时,应按照剂型、含量、装量、包装数量、包装材料、包装形式差比价的顺序进行计算。
其中:
(一)注射剂中剂型差比价与含量差比价混合计算,以小容量注射液(普通粉针)为代表品计算冻干粉针(溶媒结晶粉)、大容量注射液价格,或以冻干粉针(溶媒结晶粉针)为代表品计算大容量注射液价格的,应先计算含量差比价,再计算剂型差比价。反向计算的,应先计算剂型差比价,再计算含量差比价。
注射剂非代表品单支价格低于0.2 元的,按0.2 元核定;若非代表品规格小于代表品的,其价格不得超过代表品单支价格。
(二)溶液剂(颗粒剂、散剂)与口服片剂(胶囊剂)计算含量差比价,单剂量包装的溶液剂(颗粒剂、散剂)与口服片剂(胶囊剂)之间,以溶液剂(颗粒剂、散剂)最小独立包装的含量和口服片剂(胶囊剂)最小计量单位的含量为基础计算含量差比价;多剂量包装的溶液剂(颗粒剂、散剂)与口服片剂(胶囊剂)之间,应先按前述方法计算单剂量包装的价格,再安装量差比价计算多剂量包装的价格。
第十七条 有下列特殊情况之一的,应单列代表品计算差比价:
(一)非代表品与代表品的给药途径和剂型均相同,而适应症或功能主治完全不同的(不包括适应症或功能主治的增加和减少);
(二)非代表品明确为仅限于小儿使用的;
(三)非代表品与代表品含量差异大于或等于 8 倍的。
第十八条 有下列特殊情况之一,并在临床上具有重要意义的,可单列代表品计算差比价:
(一)使用特殊给药装置,由患者院外自行给药的注射类和喷射类制剂;
(二)适应症或功能主治部分改变,对临床产生重大影响的;
(三)口服片剂、胶囊剂中代表品为单剂量包装,非代表品为多剂量包装,且价格不高于相同剂型规格单剂量包装的;
(四)由于药物本身特性等原因,剂型或规格改变对药品疗效、安全性等产生重大影响的。
第十九条按差比价计算零售价格时,尾数按四舍五入的原则取舍。1 元以下,零售价格尾数保留到分;1 元(含1 元)至100 元,零售价格尾数保留到角;100 元以上(含100 元),零售价格尾数保留到元。
第二十条 本规则下列用语的含义:
(一)“同种药品”,是指有效成分相同的药物制剂,其中:化学药品和生物制品,凡中文通用名或英文国际非专利药名(INN)中表达的有效成分相同的药物制剂,归类为同种药品。有效成分相同,虽命名不同或命名中酸根、碱基、金属元素、有效成分的结晶形式、结晶水数量、配比、溶媒及其他辅料等不同,也归类为同种药品。
中成药和天然药,凡国家标准规定的正式品名中剂型前的名称相同且处方相同的药物制剂,归类为同种药品。
认定化学药品、生物制品、中成药和天然药,应以国家药品监督管理部门的批准文号和有关规定为依据。
(二)“代表品”,是指同种药品中作为其他剂型规格品价格计算基础的剂型规格品。
(三)“含量”,是指药物制剂最小计量单位中包含的国家标准规定的有效成分、指标成分或活性单位的数量。
(四)“装量”,是指最小独立包装中标示的药物制剂的面积、容量或重量。
(五)“日治疗量”,是指按照药品说明书所示,与主要适应症或功能主治相匹配的每日使用剂量的平均值。
(六)“包装数量”,是指最小零售包装(不包括医院住院药房拆零出售的包装)内包含的按最小计量单位计算的制剂数量。
(七)“包装材料”,是指药品最小独立包装中,与药物制剂直接接触的药用包装材料。
(八)“单剂量包装”,是指最小零售包装内,以不超过药品单次服用的剂量为单元,彼此间通过包装材料(胶囊壳除外)进行密封,不直接接触的包装形式。
(九)“多剂量包装”,是指最小零售包装内,以超过药品单次服用的剂量为单元,彼此间无包装材料(胶囊壳除外)进行密封,直接接触的包装形式。
第二十一条本规则未明确差比价关系的,由省级价格主管部门根据本规则第四条规定,暂定差比价关系并抄报国家发展改革委。
第二十二条 本规则自 2012 年1 月1 日起执行。2005 年1月7 日国家发展改革委发布的《药品差比价规则(试行)》及相关规定同时废止。
什么是理论片数
滴定液配制、标定、使用和储存
1.1滴定液系指在容量分析中用于滴定被测物质含量的标准溶液,具有准确的浓度。
1.2滴定液的浓度以“mol/L”表示,其基本单元应根据药典规定。
1.3滴定液的浓度值与其名义值之比,称为“F”值常用于容量分析中的计算。
1.4本法适用于中国药典2000年版二部附录“滴定液”的配制与标定。
2仪器与用具
2.1分析天平
其分度值应为0.1mg或小于0.1mg;毫克组砝码需经校正,并列有校正表备用。
2.2滴定管
10、25和50ml滴定管应经校正。
2.3移液管
10、15、20和25ml移液管应经校正。
2.4量瓶
250ml和1000ml量瓶应符合国家A级标准,或附有校正值。
3试药与试液
3.1均应按照中国药典附录“滴定液”项下的规定取用。
3.2基准试剂应有专人负责保管与领用。
4配制
滴定液的配制方法有间接配制法与直接配制法两种,应根据规定选用,并应遵循下列有关规定。
4.1所用溶剂“水”系指纯化水,在未注明有其他要求时,应符合中国药典“纯化水”项下的规定。
4.2采用间接配制法时,溶质与溶剂的取用量均应根据规定量进行称取或量取,并使制成后滴定液的浓度值应为其名义值的0.95~1.05;如在标定中发现其浓度值超出其名义值的0.95-1.05范围时,应加入适量的溶质或溶剂予以调整。当配制量大于1000ml时,其溶质与溶剂的取用量均应按比例增加。
4.3采用直接配制法时,其溶质应采用“基准试剂”,并按规定条件干燥至恒重后称取,取用量应为精密称定,并置1000ml量瓶中,加溶剂溶解并稀释至刻度,摇匀。配制过程中应有核对人,并在记录中签名以示负责。
4.4配制浓度等于或低于0.02mol/L的滴定液时,除另有规定外,应于临用前精密量取浓度等于或大于0.1mol/L的滴定液适量,加新沸过的冷水或规定的溶剂定量稀释制成。
4.5配制成的滴定液必须澄清,必要时可滤过;并按药典中各该滴定液项下的[贮藏]条件贮存,经下述标定其浓度后方可使用。
5标定
“标定”系指根据规定的方法,用基准物质或已标定的滴定液准确测定滴定液浓度(mol/L)的操作过程;应严格遵照药典中各该滴定液项下的方法进行标定,并应遵循下列有关规定。
5.1工作中所用分析天平及其砝码、滴定管、量瓶和移液管等,均应经过检定合格;其校正值与原标示值之比大于0.05%时,应在计算中采用校正值予以补偿。
5.2标定工作宜在室温(10~30℃)下进行,并应在记录中注明标定时的室内温度。
5.3所用基准物质应采用“基准试剂”,取用时应先用玛瑙研钵研细,并按规定条件干燥,置干燥器中放冷至室温后,精密称取,易引湿性的基准物质宜采用“减量法”进行称重。如系以另一已标定的滴定液作为标准溶液,通过“比较”进行标定,则该另一已标定的滴定液的取用应为精密量取(精确至0.01ml),用量除另有规定外应等于或大于20ml,其浓度亦应按药典规定准确标定。
5.4根据滴定液的消耗量选用适宜容量、规格的滴定管;滴定管应洁净,玻璃活塞应密合、旋转自如,盛装滴定液前,应先用少量滴定液淋洗3次,盛装滴定液后,宜用小烧杯覆盖管口。
5.5标定中,滴定液应从滴定管的起始刻度开始,按规定控制滴定速度;滴定液的消耗量,除另有特殊规定外,应大于20ml,读数应估计到0.01ml。
5.6标定中的空白试验,系指在不加供试品或以等量溶剂替代供试液的情况下,按同法操作和滴定所得的结果。
5.7标定工作应由初标者(一般为配制者)和复标者在相同条件下各作平行试验3份;各项原始数据经校正后,根据计算公式分别进行计算;3份平行试验结果的相对偏差,除另有规定外,不得大于0.1%;初标平均值和复标平均值的相对偏差也不得大于0.1%,标定结果按初、复标的平均值,取4位有效数字。
5.8直接法配制的滴定液,其浓度应按配制时基准物质的取用量与量瓶的容量以及计算公式进行计算,最终取4位有效数字。
5.9 临用前按稀释法配制浓度等于或低于0.02mol/L的滴定液,除另有规定外,其浓度可按原滴定液(浓度等于或大于0.1mol/L)的标定浓度与取用量(加校正值),以及最终稀释成的容量(加校正值),计算而得。
6贮藏与使用
6.1滴定液在配制后应按药典规定的[贮藏]条件贮存,一般宜采用质量较好的具玻璃塞的玻瓶。
6.2应在滴定液贮瓶外的醒目处贴上标签,内容包括:滴定液名称、浓度或校正因子、标定日期、标定温度、配制者、标定者、复标者。
6.3滴定液经标定所得的浓度或其“F”值,除另有规定外,可在3个月内应用;过期应重新标定。当标定与使用时的室温相差未超过10℃时,除另有规定外,其浓度值可不加温度补正值;但当室温之差超过10℃,应加温度补正值,或按(5.7)的要求重新进行标定。
6.4当滴定液用于测定原料药的含量时,为避免操作者个体对判断滴定终点的差异而引入的误差,必要时可由使用者按(4.5.7)的要求重新进行标定;其平均值与原标定值的相对偏差不得大于0.1%,并以使用者复标的结果为准。
6.5取用滴定液时,一般应事先轻摇贮存有大量滴定液的容器,使与粘附于瓶壁的液滴混合均匀,而后分取略多于需用量的滴定液置于洁净干燥的具塞玻瓶中,用以直接转移至滴定管内,或用移液管量取,避免因多次取用而反复开启贮存滴定液的大容器;取出后的滴定液不得倒回原贮存容器中,以避免污染。
6.6当滴定液出现浑浊或其他异常情况时,该滴定液应即弃去,不得再用。
7附注
为便于分析工作中的计算,部分基层单位,对以水为溶剂、浓度为0.1mol/L的滴定液,常要求配制成F值恰为1.000的滴定液;即在前述标定后,根据下列情况,通过计算,加入计算量的水或F2值约5的浓滴定液以调整其浓度,摇匀后,再按(5.7)的要求进行标定,必要时可再次调整,用以制得F值恰为1.000的滴定液。
7.1F1值大于1.000时,应加入计算量(V2)的水进行稀释,摇匀并标定。
7.1.1计算公式:
∵F1·V1=1.000(V1+V2)
∴V2=(F1-1.000)·V1/1.000
式中
F1为原滴定液的F值;
V1为原滴定液的体积,ml;
V2为要求稀释后的F值恰为1.000时需要在原滴定液中加入的水量(ml)。
7.1.2举例如有盐酸液(0.1mol/L)9000ml,经取出150ml进行标定,结果其F值为1.036(F1);问需加水多少毫升(V2)?经摇匀后可使其F值恰为1.000。
根据上列公式计算,其中V1为8850(9000-150)ml,F1为1.036;则V2应为319ml。
取水319ml,加入于上述F值为1.036的盐酸液(0.1mol/L)8850ml中,摇匀,再经标定后,可得F值为1.000的盐酸液(0.1mol/L)。
7.2F1
值小于1.000时,应加入计算量(V2)的F2值约为5的浓滴定液,以增加溶质使其F值恰为1.000。
7.2.1计算公式
∵F1V1+F2V2=1.000(V1+V2)
∴V2=(1.000-F1)V1/(F2-1.000)
式中 F1为原滴定液的F 值;V1 为原滴定液的体积(ml);F2为浓滴定液的F 值;V2为要求增浓后的F值恰为1.000时需要在原滴定液中加入F2浓滴定液的体积(ml)。
7.2.2举例
如有氢氧化钠液 (0.1ml/L)5000ml,经取出150ml进行标定,结果其F值为0.953(F1);问需加浓度为0.5240mol/L 氢氧化钠滴定液多少毫升(V2)?经摇匀后可使值F值恰为1.000。
根据上列公式,其中F1为0.953,V1为4850(5000-150)ml,F2为5.240(0.5240/0.1000);则V2应为53.8ml。
取浓度为0.524mol/L的氢氧化钠滴定液53.8ml,加入于上述F值为0.953的氢氧化钠液(0.1mol/L)中,摇匀,再经标定,可得F值为1.000的氢氧化钠液(0.1mol/L)。
片剂的生产,有投料前必须详细周密地制定投料计划,比如,本批药片,准备生产10万个药片,每个药片的主药含量是0.1克,那么你会很容易地计算出应该投入多少原料药,但在生产地过程中,尚需要添加不少的辅料,因而终产品的药片片重肯定不只0.1克,还要包括辅料的重量.计算公式中的理论片数也就是投料前设定的计划生产片数.
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。