原料药分析研发思路-原料药重点分析项目

网讯原料药产品营收大幅增长,肝素原料药龙头之一千红制药(002550.SZ)拟以自有资金6亿元新建原料药生产基地项目。
据千红制药9月21日披露的公告,公司9月20日与湖北省钟祥市人民政府签订了《常州千红制药原料药生产基地项目合同书》。
该生产基地分为两期建设:一期项目将新建多糖类产品生产线、高端抗血栓药物生产线、药用蛋白酶药物生产线、粗胰酶原料生产线等及相关配套辅助设施;二期项目将新建药包材生产线、靶向抗肿瘤药物生产线等及相关配套辅助设施。
项目达产后,将形成高端抗血栓药物6.5吨、粗胰酶125吨、药用蛋白酶750亿单位、靶向抗肿瘤原料药5吨、药包材10000万支的年生产能力。
对于此次新建原料药项目,千红制药称,将进一步拓展公司新药及核心产品产业链,增强公司核心竞争力。但对财务数据/利润表影响尚不明确。
资料显示,千红制药主要产品包括生物药用酶系列产品和肝素系列产品两大类,公司拥有国内最完整的肝素系列全产业链,肝素钠系列产品属临床抗凝刚需用药,是千红制药在这一细分领域的核心竞争力之一。
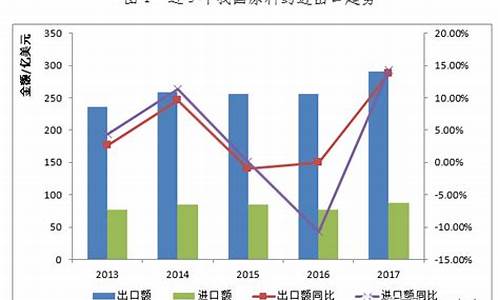
财经网注意到,今年上半年,千红制药原料药产品营收占比大幅提升,并成为公司营收增速最快的业务。
据财报数据披露,上半年,千红制药实现营收11.37亿元,同比增长30.23%;归属净利润2.02亿元,同比大增126.42%。报告期内,原料药系列实现营收5.55亿元,同比增长61.87%;制剂药品系列实现营收5.79亿元,同比增长9.44%。
二级市场上,千红制药股价年初走出一波上涨行情,并于1月底达到年内高点8.43元/股,此后震荡下跌,截至9月21日收盘,千红制药股价报5.64元/股。
原料药简称API,即药物活性成分,也是构成药物药理作用的基础物质。但原料药一般不能直接作为药品,需要经过辅料添加等步骤制成制剂方能被患者使用。根据所处产品周期不同,原料药可分为大宗原料药、特色原料药和专利原料药。
我国是原料药生产大国和出口大国,近年来随着医改新政策的推进,以及全球订单转移等因素的影响,我国原料药行业规模不断扩大。
除千红制药外,原料药企业海普瑞、国邦医药今年上半年业绩也大幅增长。其中,海普瑞2022年上半年归属净利润5.11亿元,同比增长51.15%;国邦医药上半年归属净利润4.95亿元,同比增长31.07%。
但从整个板块来看,一方面受疫情封控影响物流发货受阻,另一方面由于原材料价格上涨导致成本增加,原料药板块上半年收入、利润增速放缓,业绩承压。
以普洛药业为例,其上半年在营收增长16.57%的同时营业成本上升25.44%,导致净利率同比下降21.04%,公司也在中报中坦言,部分大宗商品价格的急剧上涨导致成本大幅增加。
不过,西南证券研报指出,长期来看,原料药企业可通过丰富产品管线,提升市场竞争力;《十四五医药工业发展规划》鼓励原料药企业向下游延伸,实现原料药+制剂一体化,巩固原料药制造优势;原料药企业向中国医药新制造重点发力的高端创新药CDMO拓展,有望打开长期成长空间。
随着中国原料药企GMP、EHS等体系的逐渐完善,中国原料药产品附加值逐渐提升,已经逐渐建立起直接向规范市场供应能力,在全球医药产业链中地位正在提升。中金公司认为,原料药产业链地位不断提升,集中度有望持续提升;原料药公司采取差异化竞争策略,如抢仿、客户合作、制剂一体化和难仿等策略,有望实现差异化业绩兑现节奏。
药物立项步骤还有所需要的数据是什么?
原料药分析是指对于没有经过加工的药物原料的分析,工作主要是关于所用药物的分子式等有关的药物分子结构的分析,以及粒径大小等与其溶解度有关的性质分析,制剂分析中主要考虑的是制剂因素对于药物的溶解度以及溶出速度和生物利用度等有关的因素,不仅包括了药物本身的性质分析,也包括了剂型因素,处方设计,以及辅料应用和制备工艺的分析,不知道这么说楼主明白不
采用高效液相色谱法测定化学原料药时,如何论证方法的专属性
药物立项调研都是要查询数据的,从调研药物基本信息(理清适应症,确定参比制剂)-国内外上市情况(分析对手,评估注册难度)-专利查询(避免侵权)-临床优势(临床优势越好,市场越大)-法规可行性(降低项目成本)-市场数据(分析市场前景,计算投入产出比)-原料药到决策分析等,无疑这些数据都需要医药数据库查询,以下简单介绍以下调研步骤。
药物立项步骤
1、调研药物基本信息
可以在一致性评价数据库下,查询原研药物数据,可以在“橙皮书”或者“仿制药参比制剂目录”查询,这一步能确定药物的参比制剂,在全球上市药品可以查询药品的说明书这些主要目的是为了:理清适应症,确定参比制剂。
原研数据(参比制剂)
2、调研国内外上市情况
可以在中国药品审评和中国药品批文查询国内药物上市和未上市的情况,在全球上市药物数据中查询,这一步的主要目的是分析竞争情况,查询竞争对手数量。还能分析过审的难度,这些在药监局也能查询但是综合的数据库数据更加全面,更加的利于分析。
这一部分主要查询上市受理情况和一致性评价情况(分析竞争对手),临床备案情况(申报进度以及BE难度)以及CDE原料药的备案情况,这些主要让我们对于自己的项目有个大概的认知。
国内外上市情况
3、调研专利数据
专利数据这一点是非常重要的,专利产权问题是药企的核心点之一,调研专利需要调研核心专利,同族专利、工艺专利等等,这些可能需要团队的配合,可以在全球专利数据和中国专利数据查询,主要目的是:避免专利侵权
专利数据调研
4、调研临床优势
药品的临床安全性,优势越大,那么这个药品的市场就越大,可以在临床数据库中查询药物的安全性,可以分辨药物临床优势。
5、查询市场数据
查询市场数据,查询药物销售数据,这些都是需要专业的数据库,还有一种方法是可以在上市企业年报查询,还能在微信公众号查询碎片化的数据,还能在各大财富网站了解,以及雪球了解,但是这些数据唯一就是数据精准度不高,整合麻烦,可以通过查询药品在药店和在医院的销售数据:分析市场前景,计算投入和产出比。
市场数据
6、查询原料药情况
可以查询原料药基本信息(最佳合成路线,中间体、试体等),质量标准查询、可行性查询,这些主要是为了进行技术评估,进入最后阶段,可以在原料药数据库里查询到这些数据。
最后就是项目评估、决策阶段了,数据库能帮助药物立项调研中所有想要了解的数据,为立项调研提供决策,为药物研发提供支持,当然数据库也能为医药投资做出决策。
采用高效液相色谱法测定化学原料药时,论证方法的专属性为:需要验证的检测项目检测项目是为控制药品质量,保证安全有效而设定的测试项目。
根据检测项目的设定目的和验证内容的不同要求,本指导原则将需验证的检测项目分为鉴别、杂质检查(限度试验、定量试验)、定量测定(含量测定、溶出度、释放度等)、其他特定检测项目等四类。
测定方式分析
鉴别判定被分析物是目标化学原料,而非其它物质,用于鉴别的分析方法要求具有较强的专属性。杂质检查主要用于控制主成分以外的杂质,如有机杂质、无机杂质等。
而其中杂质检查可分为限度试验和定量试验两种情况。用于限度试验的分析方法验证侧重专属性和检测限。用于定量试验的分析方法验证强调专属性、准确度和定量限。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。