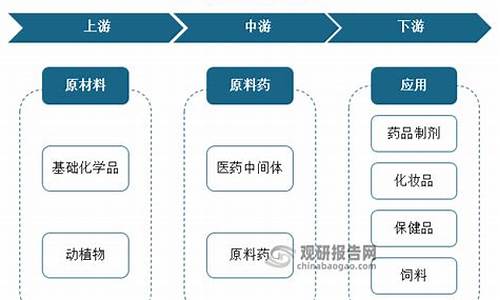
原料药的概念-原料药的概念和特点

2022年阿兹夫定龙头上市公司有: 1、拓新药业301089:阿兹夫定龙头股。 公司2021年实现营业收入5.02亿元,同比增长-4.82%;归属于上市公司股东的净利润6571.1万元,同比增长-41.75%;归属于上市公司股东的扣除非经常性损益的净利润6267.51万元,同比增长-41.04%。 公司通过技术审评的抗HIV产品有阿兹夫定原料药,合作研发。 7月7日消息,拓新药业今年来涨幅上涨43.38%,截至10时22分,该股报129.01元,跌4.31%,换手率1.07%。 2、新华制药000756:阿兹夫定龙头股。 2021年新华制药实现营业收入65.6亿元,同比增长9.23%;归属于上市公司股东的净利润3.49亿元,同比增长7.29%;归属于上市公司股东的扣除非经常性损益的净利润2.91亿元,同比增长0.19%。 与真实生物签署了《战略合作协议》,同意公司为其拥有的阿兹夫定等产品在中国及经双方同意的其他国家的产品生产商和经销商。而真实生物手握的阿兹夫定(Azvudine)是最近广受舆论关注的一款新冠口服药,也是目前国内多款在研新冠口服药进展最快的之一。 新华制药7月7日股价,截至10时22分,该股跌5.11%,股价报25.65元,成交25.74万手,成交金额5292.24万元,换手率0.46%,最新A股总市值175.84亿元。 阿兹夫定概念股其他的还有: 翰宇药业:在近7个交易日中,翰宇药业有4天上涨,期间整体上涨6.43%,最高价为15元,最低价为12.84元。和7个交易日前相比,翰宇药业的市值上涨了8.53亿元。 山河药辅:近7日股价上涨7.19%,2022年股价下跌-50.4%。 华润双鹤:近7个交易日,华润双鹤上涨22.23%,最高价为22.17元,总市值上涨了69.17亿元,2022年来上涨54.83%。 圣济堂:近7个交易日,圣济堂下跌4.23%,最高价为3.12元,总市值下跌了2.2亿元,下跌了4.23%。
1、简述药剂学、剂型、制剂的概念? 2、药物剂型有何重要性?
肝素钠概念上市公司有:
1、常山药业:公司2021年第一季度总营收7.11亿,毛利率61.19%,每股收益0.0700元。主要肝素类产品有,肝素钠原料药、肝素钠注射液、依诺肝素钠原料药、达肝素钠原料药、低分子量肝素钙原料药、达肝素钠注射液和低分子量肝素钙注射液。
2、双鹭药业:公司2021年第一季度总营收2.53亿,毛利率87.69%,每股收益0.0900元。公司基因工程产品、替莫唑胺、杏灵滴丸、依诺肝素钠等受益于招标推进实现40%以上的销售量的快速增长。
3、千红制药:公司2021年第一季度总营收3.91亿,毛利率44.56%,每股收益0.0400元。公司肝素钠原料药的质量控制水平已达到国际先进水平,已通过了欧盟COS认证及德国,澳大利亚,巴西,韩国GMP认证,公司生产的可作为依诺肝素原料的肝素产品已通过美国FDA的现场检查,肝素钠原料药现正在申请进行美国FDA的认证工作,“达肝素钠”原料药已于2010年3月获得日本厚生省的进口许可,公司胰激肽原酶原料药及制剂的产品质量内控标准已被国家药典委员会提升为国家药品标准。
4、海普瑞:公司2021年第一季度总营收12.68亿,毛利率32.97%,每股收益0.0978元。公司生产所采用的核心技术——肝素钠原料药提取和纯化技术,包括杂质与组分分离技术,病毒和细菌灭活技术,基团完整性保护和活性释放技术,定向组分分离技术。
5、健友股份:2021年第二季度,公司实现总营收8.68亿,毛利率57.37%,每股收益0.3000元。肝素制剂方面,公司已经取得了CFDA对包括依诺肝素钠注射液、达肝素钠注射液和那屈肝素钙注射液在内的主要低分子肝素制剂品种的《药品注册批件》。
股市有风险,投资需谨慎。
药品的概念不包括( )。
药剂学是研究药物配制理论、生产技术以及质量控制等内容的综合性应用技术学科
剂型为具有一定组分和规格的药剂加工形态;将原料药加工制成适合于医疗或预防应用的形式。
制剂;根据药典或其他处方按照一定操作规程将药物加工制成的药剂
剂型的重要性;
①剂型可改变药物的作用性质
②剂型能改变药物的作用速度,例如,注射剂、吸入气雾剂等,速效制剂常用于急救;丸剂、缓释控制剂、植入剂等属长效制剂。
③改变剂型可降低(或消除)药物的毒副作用
④剂型可产生靶向作用
⑤剂型可影响疗效
兔用兽药的概念、类型及其使用方法如何?
答案:E
《中华人民共和国药品管理法》对药品的定义是指:用于预防、治疗、诊断人的疾病,有目的地调节人的生理机能并规定有适应证或者功能主治、用法和用量的物质。包括中药材、中药饮片、中成药、化学原料药及其制剂、抗生素、生化药品、放射品、血清、疫苗、血液制品和诊断药品等。
中药饮片厂算是生产原料药的吗
(1)兽药概念
兽药是指用于预防、治疗、诊断动物疾病或者有目的地调节动物生理机能的物质(含药物饲料添加剂),主要包括:血清制品、疫苗、诊断制品、微生态制品、中药材、中成药、化学药品、抗生素、添加剂、生化药品及外用杀虫剂、消毒剂等。
(2)兽药类型
按使用方式分
①兽用处方药,是指凭兽医处方方可购买和使用的兽药。②兽用非处方药,是指由兽医行政管理部门公布的、不需要凭兽医处方就可以自行购买并按照说明书使用的兽药。
按药物来源分
①天然药物,植物、动物、矿物和微生物发酵产生的抗生素。②合成药物,人工合成的各种抗菌化合物、生物技术产品(通过细胞或基因工程技术生产的药物)。
按药物应用类型分
①原料药(纯粉),生产各种制剂的药物原料。②制剂(成品),经过加工制成的安全、稳定和便于应用的药物剂型,如粉剂、片剂、液体剂、气雾剂型。
(3)药物的基本作用
①对因治疗,消除疾病的原发致病因子(治本),如化疗药物杀灭病原微生物以控制感染性疾病。②对症治疗,改善疾病的症状(治表),如解热镇痛药使高烧患畜暂时缓解症状,但若病因不除,药物作用过后体温又会升高。
化学新药的毒理研究是用原料药么
中药饮片是中药材经过按中医药理论、中药炮制方法,经过加工炮制后的,可直接用于中医临床的中药。这个概念表明,中药材、中药饮片并没有绝对的界限,中药饮片包括了部分经产地加工的中药切片(包括切段、块、瓣),原形药材饮片以及经过切制(在产地加工的基础上)、炮炙的饮片。前两类管理上应视为中药材,只是根据中医药理论在配方、制剂时作饮片理解。而管理意义上的饮片概念应理解为:“根据调配或制剂的需要,对经产地加工的净药材进一步切制、炮炙而成的成品称为中药饮片”。
新药注册中的化药3+3类;化药4+4类;化药3+6类;都是什么意思呢?
1基毒性杂质
基毒性杂质(或遗传毒性杂质Genotoxic Impurity GTI)指化合物本身直接或间接损伤细胞DNA产基突变或体内诱变具致癌能或者倾向潜基毒性杂质(Potential Genotoxic Impurity PGI)结构看类似基毒性杂质警示性未经实验证明黄曲霉素类、亚硝胺化合物、甲基磺酸酯等化合物均见基毒性杂质许化疗药物具定基毒性良反应由化疗药物细胞基毒性所致顺铂、卡铂、氟尿嘧啶等
2何着重研究基毒性杂质
基毒性物质特点低浓度即造体遗传物质损伤进导致基突变并能促使肿瘤发其毒性较强用药安全性产强烈威胁近越越现已市药品发现痕量基毒性杂质残留发范围医疗事故FDA强行召案例给药厂造巨经济损失例某知名际制药巨欧洲市场推HIV蛋白酶抑制剂维拉赛特锭(Viracept mesylate)2007 7月EMA暂停欧洲所市场其产品发现甲基磺酸乙酯超标甲基磺酸乙酯种经典基毒性杂质该企业付巨代价先内部调查残留超标原仪器设备清洗乙醇未完全清除残留与甲基磺酸反应形甲基磺酸乙酯要求解决污染问题要求做毒性研究更评估患者风险同达25000 名患者暴露于已知遗传毒性直解决所问题 EMA才恢复欧洲市场授权
近各规机构ICH、FDA、EMA等都基毒性杂质更明确要求越越药企新药研发程着重关注基毒性杂质控制检测
3哪些化合物基毒性杂质
杂质结构种于绝数杂质言往往没充毒性或致癌研究数据难其进行归类缺乏安全性数据支持情况些规指导原则采用警示结构作区普通杂质基毒性杂质标志于含警示结构杂质应进行(Q)SAR预测体内外遗传毒性致癌性研究或者杂质水平控制毒理关注阈(TTC)
目前般致癌物两类:类遗传毒性致癌物通化键合直接破坏遗传物质产致癌性 数化致癌物具遗传毒性; 第二类非遗传毒性致癌物 通与发化键合作用 产直接破坏 通遗传物质外间接机制引起致癌作用( 促进细胞度增殖等)
文献警示结构汇总于(见原文PDF)关于基杂质警示结具体详细信息另外参考欧盟发布警示结构《Development of structure alerts for the in vivo micronucleus assay in rodents》或进入 The Carcinogenic Potency Database (CPDB)面 1547 种致癌物质列表结构式CAS 号作用部位TTC 值等系列信息应注意 含警示结构并意味着该杂质定具遗传毒性 确认遗传毒性物质定产致癌作用杂质理化性质其结构特点(相质量、亲水性、称性 / 空间位阻、反应性及物代谢速率等)其毒性产抑制或调节作用警示结构重要性于提示能存遗传毒性致癌性 进步杂质安全性评价控制策略选择指明向
4基毒性杂质规要求及限度
初ICH相继推原料药杂质研究指导原则Q3A(R2)、制剂杂质研究指导原则 Q3B(R2)些指导原则提及于能够产强药理性或毒性潜杂质即使其含量低于0.1%仍建议进行结构鉴定研究修订版进步明确要关注原料药潜遗传毒性杂质及于毒性非强杂质能需要制定更低限度其并未明确阐述遗传毒性杂质研究控制问题未提具体研究原则、控制策略限度要求
EMA(欧洲药物评审组织)推《遗传毒性杂质限度指导原则》, 引入接受风险摄入量即毒性物质限量或称毒理关注门槛(TTCThreshold of Toxicological Concern)概念设置限度值 TTC(1.5 μg/day)即相于每摄入1.5 μg基毒性杂质认于数药品说接受风险(致癌风险于十万)按照阈值根据预期每摄入量计算物接受杂质水平需要指TTC风险管理工具采用概率假基毒性杂质并且我毒性太解每摄
化药3+3类中前一个3是指原料药按3类注册申报,后一个3是指制剂也按3类注册申报;化药4+4类是指原料药按4类注册申报,其制剂按4类注册申报;化药3+6是指原料药按3类注册申报,其制剂按6类注册申报.
几加几,就指原料药按几类注册申报,其制剂按几类注册申报。
扩展资料
化学药品具体的注册分类办法如下:
一、化学药品注册分类
1、未在国内外上市销售的药品:
(1)通过合成或者半合成的方法制得的原料药及其制剂;
(2)天然物质中提取或者通过发酵提取的新的有效单体及其制剂;
(3)用拆分或者合成等方法制得的已知药物中的光学异构体及其制剂;
(4)由已上市销售的多组份药物制备为较少组份的药物;(5)新的复方制剂。
2、改变给药途径且尚未在国内外上市销售的制剂。
3、已在国外上市销售但尚未在国内上市销售的药品:
(1)已在国外上市销售的原料药及其制剂;
(2)已在国外上市销售的复方制剂;
(3)改变给药途径并已在国外上市销售的制剂。
4、改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药及其制剂。
5、改变国内已上市销售药品的剂型,但不改变给药途径的制剂。
6、已有国家药品标准的原料药或者制剂。
百度百科-化学药品
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。