原料药出口-原料药出口数据
你好,
这位朋友,
你的问题我来给你回答,
据你的描述,问题比较清楚,一定要在国内取得注册文号,进行药品检验,合格之后才可以办出口管理手续。这个是药品出口的前提。
好了基本上就是这些,
如果还有疑问呢
请继续咨询,
谢谢!
做原料药及制剂的出口需要什么资质么
GMP认证(一般跟工厂那边出的),
COA认证(去商检局办理),
自由销售证书(需要去商检局办理),
一般药品有点麻烦,建议找一个有实力的货代来协助完成比较好。
我是制药工程专业的女生 想请教是做原料药出口好 还是做药品质检(如QA或者QC等) 或者还有其他更好的选择
都是药监局管理里的,现在都是省局来进行认证。国内是遵循一个GMP,原料药还遵循GMP的原料药附录。制剂认证一般是按剂型进行认证,原料药是按产品进行认证。发证书时也是,制剂按剂型发GMP证书,原料是按产品发GMP证书。国外一般原料药认证是遵循ICH 的Q7。
国内的药企想出口原料药/制剂,怎么寻找目的市场合作客户?
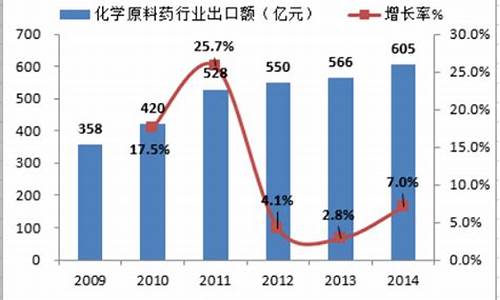
中国和印度是原料药出口的2大国家,而从长远看,中国甚至会超过印度成为全球最大的原料药出口国,因此做原料药出口的前景是不错的。
从待遇上讲,销售人员有提成,收入可能会较高,但通常做销售是有任务的,要是完不成销售额,压力会较大。而做质量的话,工作相对会比较稳定,压力没销售大,相对应地,收入也是很稳定地在一定水平。
原料药往伊朗出口 需要提供杂质么
参加国外的医药医疗和制剂科技博览会,与国外的制药公司洽谈,寻求合作,嵌入对方的工艺流程,提供其中的某一个制剂,取得对方的技术和专业审核认可,成为对方某一产品的一个不可分割的工银链中的一环,你就成功了。
在研发过程中,前期的晶型研究后,一般会开始路线的筛选,一般会基于成本或杂质控制的难以程度,以及 专利的问题选择合适的路线。在路线走通的过程中,势必会发现很多未知的杂质,杂质有大有小,有多有少。但是并不是所有的杂质都需要管控,一般认为低于0.1%的就不需要管控,除非它后续反应中有富集现象,或是后续制成对其完全没有移除效果。针对某些偏大的杂质,一定要去对其结构有适当的推导,若无法推导结构就一定要有有效的控制手段将其控制在一定的限度,以免影响后续API的品质。批次间不应该出现忽高忽低的现象。这表明制程的不可控性。
杂质研究应该建立杂质谱(impurity profile)了解杂质的来龙去脉。在路线相同的情况下,文献报道的杂质会有一定的参考意义,若是新路线则参考意义并不是很大,还是需要研发人员研究的过程中合理的去建立杂质限度。其基本的原则是确保该杂质不会影响最后API里面的杂质大小。所以若对于API没有影响,即使杂质有10%以上我们也不需要管。若对API影响很大或是毒性很强(如GTI),即使小于0.1%, 也需要移除。具体的可以查询药智网,回答满意请您采纳,谢谢。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。