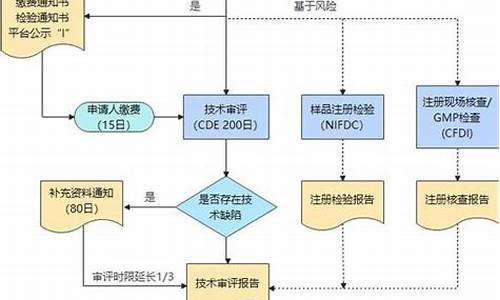
原料药备案申请流程及材料-原料药备案申请流程
关于原料药是否可以自己公司注册标准而不执行国家标准的问题,需要明确以下几点:
首先,药品作为一种特殊的商品,其质量直接关系到公众的健康和安全。因此,各国政府都对药品的生产、销售和使用制定了严格的法律法规和标准。在中国,药品的生产必须遵循《药品管理法》等相关法律法规以及国家药品标准。
其次,原料药作为药品的重要组成部分,其质量同样受到严格的监管。原料药的生产企业需要根据国家药品标准制定自己的生产工艺和质量标准,并经过药品监管部门的审批和备案。这些标准通常会在国家药品标准的基础上,结合企业自身的实际情况进行细化和完善。
然而,这并不意味着原料药生产企业可以完全脱离国家标准自行制定标准。国家药品标准是保障药品质量的基础性、强制性标准,所有药品生产企业都必须遵守。原料药生产企业在制定自己的标准时,必须确保不低于国家药品标准的要求,以保证原料药的质量和安全性。
此外,值得注意的是,随着全球化和国际贸易的发展,许多原料药都用于出口。在这种情况下,原料药生产企业还需要关注国际药品标准,如ICH(国际人用药品注册技术协调会)标准等,以确保产品符合进口国的质量要求。
综上所述,原料药生产企业可以根据自身实际情况制定高于国家标准的生产工艺和质量标准,但绝不能低于国家标准。同时,在参与国际贸易时,还需要关注并符合国际药品标准的要求。
以上内容是由猪八戒网精心整理,希望对您有所帮助。
美国原料药fda认证需要多长时间
作用不同。
药品登记号是生产或者已有国家标准的东西的,须经监督管理部门批准,并在批准文件上规定该产品的专有编号,此编号称为批准文号,而药品备案号,针对补充申请而言,如改变说明书、包材、原料产地,生产地址等很多需要重新完善的工作,前者是登记申请注册的,后者是补充申请,两者的区别就是其作用不同。
药品是用来预防、治疗、诊断疾病,有目的地调整人体生理机能,并规定有适应症或功能主治、用法、用量的物质。药品包括中药材、中成药、化学原料药及其制剂、抗生素、生化药品、放射品、血清、疫苗、血液制品及诊断药品等。
原料药批准文号下来后可否更换生产原料药场地?多谢各位,急用。
百度名字,这个的话是需要看你资料整理时间以及生产现场准备工作时间,FDA的资料审查时间很守时,说六个月就是六个月,不像中国的CFDA原料药注册也很麻烦。,还有注意的就是你申报的是几类产品,是新药还是仿制药。 这样如果你们厂是出口的话,建议先备案一个DMF,获得备案号之后就会在美国FDA官网展示,如果客户急需获得认证出口,那你们就必须备案后立刻进行审查,也是包括文件和现场。 如果只是原料药出口获得允许还是不算太难,难就是制剂在美国申报。具体还有好多值得注意的,一直说不清楚,可以一起讨论,ME就是做这个的 ,国际注册
原料药DMF是什么
可以更换,但需要经过药监部门批准。
如果同一生产地址,但生产线不同,程序上要简单一些,到省局安检处备案,由市级药监部门现场验收一下。生产许可证可以不变更,但GMP认证是免不了的。
如果是不同的生产地址,则需要进行生产许可证变更,程序上会麻烦一些,报省局安检处审批,现场验收后,换发生产许可证,之后GMP认证。
批准文号不受影响。
药物管理档案(Drug Master Files, DMF)是一份提交给美国FDA的保密文件,它提供了关于用于生产药物的原料、活性中间体及其设施、流程、包装及仓储等相关的信息。FDA目前接受书面递交和电子递交(eCTD)两种格式。点击免费了解FDA法规要求
DMF的主要的种类有:
I型,生产地点和厂房设施、人员(已取消);
II型,中间体、原料药和药品;
III型,包装物料;
IV型,辅料、着色剂、香料、香精及其它添加剂;
V型,非临床数据资料和临床数据资料。
虽然美国FDA没在正式文件中规定出口到美国的厂家必须上报DMF资料,但是若该产品被用做处方药时,美国FDA会派官员对生产厂家进行检查,以确定该厂的生产是否与上报资料所述相符,是否是按美国cGMP(现行GMP)要求进行生产。美国的DMF文件库是全世界制剂厂家广泛参照的一个供应商资源库,所以几乎所有想让产品推向国际的制药厂都进行DMF备案。DMF注册后有以下几个优势:
1 简化了制剂厂家申请的内容,直接以DMF备案号来代替制剂申请资料中有关单元的具体资料,减少了因向众多制剂客户提供资料而造成企业技术秘密外泄的风险;
2 取得DMF备案号的企业和其产品均会在FDA网站上公示,持有FDA给予的DMF备案号可以吸引更多的制剂客户共建合作发展关系,并在企业的竞争中被制剂客户优先考虑而获得竞争优势;
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。