原料药检测限度的确定-原料药检测限度的确定依据

例如,片剂在压片后进行内包装,压片结束后检测鉴别、含量均匀度等理化项目,而内包装之后仅取样检测微生物限度,最后成品放行的检验报告数据采用压片之后的理化项目数据和内包装之后的微生物限度数据,这样做是否可行? 答:放行,系指对一批物料或产品进行质量评价,作出批准使用或投放市场或其他决定的操作。一般情况下,如果企业对成品进行质量评价,能够确认中间产品的关键质量属性到成品时未发生变化,中间产品的检验结果能够代表成品放行前的检验结果,则可以引用中间产品的检验数据和结果。 企业如果采用这种方式,则必须对中间产品的关键质量属性到成品状态时的变化情形进行科学研究或评价,确保中间产品的检验数据能够代表最终包装完成的成品。应当注意,并非所有中间体的关键质量属性到最终放行时都不会产生变化。 2.问: 答:《药品生产质量管理规范(2010年修订)》明确要求制剂生产用每批原辅料和与药品直接接触的包装材料均应当有留样,并对留样作出了详细要求,而对于原料药则没有详细规定,但在第十二条(七)中明确规定:物料和最终包装的成品应当有足够的留样,以备必要的检查或检验。 原辅料留样的目的是为了能够有追溯性,一旦上市或未上市产品出现问题,企业能够从物料角度查找分析可能产生的原因。因此,企业还是应当根据其对成品质量影响的情形进行分析,从而决定是否留样、如何留样并形成操作规程。一般而言,原料药生产所用的起始物料、对原料药质量有直接或关键影响的那些关键物料均应当留样。 3.问:我们生产最终灭菌的大容量注射剂,从配制到灭菌的时限,工艺规程描述为不超过12小时,但实际工作中最多也超不过8小时,那么,12小时的时限是否必须要通过验证?8小时的时限也是否必须要通过验证? 答:《药品生产质量管理规范(2010年修订)》第五十七条规定:应当尽可能缩短药液从开始配制到灭菌(或除菌过滤)的间隔时间。应当根据产品的特性及贮存条件建立相应的间隔时间控制标准。 灭菌工艺的有效性不仅与灭菌参数有关,还与待灭菌物品的微生物负荷量有关。建立间隔时间控制标准的目的是为了控制待灭菌产品的微生物负荷量,使灭菌工艺能够达到相应的效果。 药液的微生物负荷量会随着时间的延长而增加。企业根据灭菌工艺能力确定可接受的最大微生物负荷量之后,应根据产品特性和贮存条件考察、建立并控制药液从配制至灭菌的时间,以控制微生物负荷量在可接受的最大范围之内。 问题中工艺规程规定的时限应当是经过验证的。如果最长的12小时时限已经过验证,根据实际工作情况,在其他条件不变的情形下,将时限缩短至8小时可不再验证。 4.问:检验人员须经过与所从事的检验操作相关的实践培训且通过考核。是不是药企的QC只要经过公司内部的岗位培训并考核合格就能上岗,不再需要经过药检或药品监管部门认可的机构培训后发证上岗? 答:《药品生产质量管理规范(2010年修订)》对检验人员提出了要求:质量控制实验室的检验人员至少应当具有相关专业中专或高中以上学历,并经过与所从事的检验操作相关的实践培训且通过考核。 该规范没有强制规定企业的检验人员需经过药检或药监部门认可的机构培训后发证上岗,其注重的是培训的有效性,企业应确保培训后检验人员检验的准确性。企业可采取理论培训、实践培训、或者师傅带徒弟等多种方式,也可以采取委托第三方机构进行培训的方式对检验人员进行培训,但必须注意,培训和考核仅仅是确保检验结果准确性的手段。
国家药品标准的主要内容——含量或效价的规定
说杂质原本原料药现带入制剂杂质标准否按照制剂标准指定
按照制剂标准重新制定说限度稍微低点比原本原料药限度0.05%现能0.1%
制剂程杂质能稍些主经历高温、高湿、光照等素嘛能现点主降解所杂质稍微点意思
关于原料药生产设备的清洁验证请教几个问题?
国家药品标准的主要内容有品名、有机药物的结构式、分子式和分子量、来源或有机药物的化学名称、含量或效价的规定、处方、制法、性状、鉴别、检查、含量或效价测定、类别、规格、贮藏及制剂等。
药品质量标准中含量或效价的规定又称为含量限度。含量限度是指用规定的检测方法测得的有效物质含量的限度。
对于原料药,用“含量测定”的药品,其含量限度均用有效物质的百分数(%)表示,此百分数均系指重量百分数。为了能正确反映药品的含量,一般应通过检查项下的“干燥失重”或“水分”,将药品的含量换算成千燥品的含量;用“效价测定”的抗生素或生化药品,其含量限度用效价单位(国际单位IU)表示。
对于制剂,含量(效价)的限度一般用含量占标示量的百分率来表示。
药物中常见残留溶剂及其限度limit怎么算出来的
行不行不是嘴巴说说就行,而是要进行风险评估。比如你的产品虽然专线,但是微生物限度要不要控制,只是做目视洁净能不能保证清洁方法能控制微生物。再比如,你的原料会不会降解,进而影响下批产品。这些都要评估,都要数据证明呀。法规是明确说了要清洁验证,可没说共线不用做,既然你要选择简略版的清洁验证,那就要有能力说服检查员,否则必定又是一个缺陷。
三种方法中,选择限度最低的那种。如果是多品种生产,同样的清洁方法,也是这样选择,作为标记化合物进行清洁验证。
一般是选择合适的浓度。
第一种,不然计算共用面积干嘛。
TOC适合。
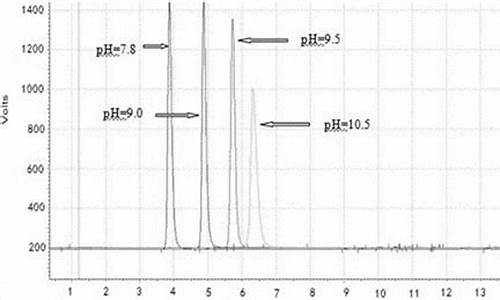
采用高效液相色谱法测定化学原料药时,如何论证方法的专属性
药品的残留溶剂基本可分为四类:第一类溶剂应避免使用。该类溶剂是指人体致癌物、疑为人体致癌物或环境危害物的有机溶剂。因其具有不可接受的毒性或对环境造成公害,在原料药、辅料以及制剂生产中应该避免使用。当根据文献或其他相关资料确定合成路线,涉及到第一类溶剂的使用时,建议重新设计不使用第一类溶剂的合成路线,或者进行替代研究。如果工艺中不可避免的使用了第一类溶剂,则需要严格控制残留量,无论任何步骤使用,均需进行残留量检测。第二类溶剂应限制使用该类溶剂是指有非遗传毒性致癌(动物实验)、或可能导致其他不可逆毒性(如神经毒性或致畸性)、或可能具有其他严重的但可逆毒性的有机溶剂。此类溶剂具有一定的毒性,但和第一类溶剂相比毒性较小,建议限制使用,以防止对病人潜在的不良影响。第三类溶剂是GMP或其他质量要求限制使用该类溶剂属于低毒性溶剂,对人体或环境的危害较小,人体可接受的粗略浓度限度为0.5%,因此建议可仅对在终产品精制过程中使用的第三类溶剂进行残留量研究。第四类溶剂是尚无足够毒性资料的溶剂这类溶剂在药物的生产过程中可能会使用,但目前尚无足够的毒理学研究资料。建议药物研发者根据生产工艺和溶剂的特点,必要时进行残留量研究。随着对这类溶剂毒理学等研究的逐步深入,将根据研究结果对其进行进一步的归类。第一类有机溶剂 是指已知可以致癌并被强烈怀疑对人和环境有害的溶剂。在可能的情况下,应避免使用这类溶剂。如果在生产治疗价值较大的药品时不可避免地使用了这类溶剂,除非能证明其合理性,残留量必须控制在规定的范围内,如: 苯(2ppm)、四氯化碳(4ppm)、1,2-二氯乙烷(5ppm)、1,1-二氯乙烷(8ppm)、1,1,1-三氯乙烷(1500ppm)。 第二类有机溶剂 是指无基因毒性但有动物致癌性的溶剂。按每日用药10克计算的每日允许接触量如下: 2-甲氧基乙醇(50ppm)、氯仿(60ppm)、1,1,2-三氯乙烯(80ppm)、1,2-二甲氧基乙烷(100ppm)、1,2,3,4-四氢化萘(100ppm)、2-乙氧基乙醇(160ppm)、环丁砜(160ppm)、嘧啶(200ppm)、甲酰胺(220ppm)、正己烷(290ppm)、氯苯(360ppm)、二氧杂环己烷(380ppm)、乙腈(410ppm)、二氯甲烷(600ppm)、乙烯基乙二醇(620ppm)、N,N-二甲基甲酰胺(880ppm)、甲苯(890ppm)、N,N-二甲基乙酰胺(1090ppm)、甲基环己烷(1180ppm)、1,2-二氯乙烯(1870ppm)、二甲苯(2170ppm)、甲醇(3000ppm)、环己烷(3880ppm)、N-甲基吡咯烷酮(4840ppm)、。 第三类有机溶剂 是指对人体低毒的溶剂。急性或短期研究显示,这些溶剂毒性较低,基因毒性研究结果呈阴性,但尚无这些溶剂的长期毒性或致癌性的数据。在无需论证的情况下,残留溶剂的量不高于0.5%是可接受的,但高于此值则须证明其合理性。这类溶剂包括: 戊烷、甲酸、乙酸、、丙酮、苯甲醚、1-丙醇、2-丙醇、1-丁醇、2-丁醇、戊醇、乙醇、乙酸丁酯、三丁甲基、乙酸异丙酯、甲乙酮、二甲亚砜、异丙基苯、乙酸乙酯、甲酸乙酯、乙酸异丁酯、乙酸甲酯、3-甲基-1-丁醇、甲基异丁酮、2-甲基-1-丙醇、乙酸丙酯。 除上述这三类溶剂外,在药物、辅料和药品生产过程中还常用其他溶剂,如1,1-二乙氧基丙烷、1,1-二甲氧基甲烷、2,2-二甲氧基丙烷、异辛烷、异丙醚、甲基异丙酮、甲基四氢呋喃、石油醚、三氯乙酸、三氟乙酸。这些溶剂尚无基于每日允许剂量的毒理学资料,如需在生产中使用这些溶剂,必须证明其合理性。溶剂名称PDE值(mg/天)限度(%)溶剂名称PDE值(mg/天)限度(%) 第一类溶剂(应避免使用)第三类溶剂(GMP或其他质量要求限制使用) 苯0.020.0002乙酸50.00.5 四氯化碳0.040.0004丙酮50.00.5 1,2-二氯乙烷0.050.0005甲氧基苯50.00.5 1,1-二氯乙烯0.080.0008正丁醇50.00.5 1,1,1-三氯乙烷15.00.15仲丁醇50.00.5 第二类溶剂(应该限制使用) 乙酸丁酯50.00.5 乙腈4.10.041叔丁基甲基醚50.00.5 氯苯3.60.036异丙基苯50.00.5 氯仿0.60.006二甲亚砜50.00.5 环己烷38.80.388乙醇50.00.5 1,2-二氯乙烯18.70.187乙酸乙酯50.00.5 二氯甲烷6.00.0650.00.5 1,2-二甲氧基乙烷1.00.01甲酸乙酯50.00.5 N,N-二甲氧基乙酰胺10.90.109甲酸50.00.5 N,N-二甲氧基甲酰胺8.80.088正庚烷50.00.5 1,4-二氧六环3.80.038乙酸异丁酯50.00.5 2-乙氧基乙醇1.60.016乙酸异丙酯50.00.5 乙二醇6.20.062乙酸甲酯50.00.5 甲酰胺2.20.0223-甲基-1-丁醇50.00.5 正己烷2.90.029丁酮50.00.5 甲醇30.00.3甲基异丁基酮50.00.5 2-甲氧基乙醇0.50.005异丁醇50.00.5 甲基丁基酮0.50.005正戊烷50.00.5 甲基环己烷11.80.118正戊醇50.00.5 N-甲基吡咯烷酮5.30.053正丙醇50.00.5 硝基甲烷0.50.005异丙醇50.00.5 吡啶2.00.02乙酸丙酯50.00.5 四氢噻吩1.60.016尚无足够毒性资料的溶剂 四氢化萘1.00.011,1-二乙氧基丙烷 四氢呋喃7.20.0721,1-二甲氧基甲烷 甲苯8.90.0892,2-二甲氧基丙烷 1,1,2-三氯乙烯0.80.008异辛烷 二甲苯①21.70.217异丙醚 甲基异丙基酮 甲基四氢呋喃 石油醚 三氯乙酸 三氟乙酸
采用高效液相色谱法测定化学原料药时,论证方法的专属性为:需要验证的检测项目检测项目是为控制药品质量,保证安全有效而设定的测试项目。
根据检测项目的设定目的和验证内容的不同要求,本指导原则将需验证的检测项目分为鉴别、杂质检查(限度试验、定量试验)、定量测定(含量测定、溶出度、释放度等)、其他特定检测项目等四类。
测定方式分析
鉴别判定被分析物是目标化学原料,而非其它物质,用于鉴别的分析方法要求具有较强的专属性。杂质检查主要用于控制主成分以外的杂质,如有机杂质、无机杂质等。
而其中杂质检查可分为限度试验和定量试验两种情况。用于限度试验的分析方法验证侧重专属性和检测限。用于定量试验的分析方法验证强调专属性、准确度和定量限。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。