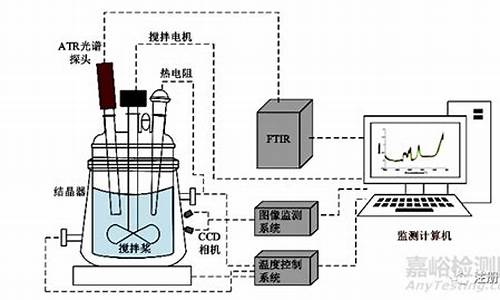
原料药晶型研究思路-原料药晶型检测
科研服务——项目承担情况 一、国家自然科学基金项目:等离子体聚合过程中自由基结构研究 二、中国科学院广州分院分析测试基金项目主要有: 1.表面活性剂的电喷雾质谱研究 2.能量分辨质谱应用研究 3.应用裂解色谱鉴定有机小分子结构 4.Sadtler.. 司法鉴定 1、法医毒物鉴定腐蚀性毒物:硝酸、盐酸、硫酸、氢氧化钠、苯酚等挥发性毒物:甲醇、甲醛、氰化物、硝基苯等金属类毒物:汞、铅、砷、钡、铬、镁等;农药:有机磷、有机氮、溴甲烷等,杀鼠剂,如磷化锌、敌鼠强、杀.. 货物运输条件鉴定、化学品检测和危险性鉴定 1、货物运输(空运、海运、公路运输、铁路运输)条件鉴定服务与咨询第1类:爆炸品第2类:气体第3类:易燃液体第4类:易燃固体,易于自燃的物质,遇水释放易燃气体的物质第5类:氧化性物质和有机过氧化物第6类:.. 工业故障诊断和失效分析 综合运用各类检测仪器进行常量、微量和痕量物质分析,对主要成分和杂质成分定性定量分析,有机分析与无机分析并重,将成分分析与生产工艺流程分析相结合,加上检测人员对对检测结果充分的分析和判断能力,对产品质量事故原.. 环境可靠性试验 1、气候环境试验低温试验、高温试验、湿热试验、低气压(高度)试验、温湿度组合循环试验、温度冲击试验、温度快速变化试验、混合气体腐蚀试验、盐雾腐蚀及氙灯、碳弧光等多种光老化试验。 2、力学环境试验振动试验.. 材料性能分析 1、高分子材料的性能(1)高分子材料的物理性能硬度、拉伸性能、弯曲性能、压缩性能、撕裂性能、冲击性能、磨擦性能附着力、铅笔硬度、密度、尺寸 (2)高分子材料的热学性能尺寸稳定性、热变形温度、维卡软化温.. 金属矿产检测 1、常规元素定量分析碳C、硫S、硅Si、锰Mn、磷P、镍Ni、铬Cr、铜Cu、镁Mg、钙Ca、铁Fe、钛Ti、锌Zn、铅Pb、镉Cd、铋Bi、砷As、锑Sb、钠Na、钾K、铝Al等 2、贵金属元素定量分析铂族金属:锇(Os)、铱(Ir)、钌(Ru)、铑(Rh.. 油品品质检测 1、石化产品常规检测项目?石油苯、石油甲苯、对(邻、间)二甲苯、混合芳烃、甲基叔丁基醚、乙酸异丙酯、乙酸甲酯、乙酸乙烯酯、丙烯酸、丙烯酸酯、乙腈、丙烯腈等?纯度分析、杂质分析、馏程、密度、酸度.. 电子电器有毒有害物质检测 1、RoHS六项有害物质检测镉以及镉化合物Cd、铅以及铅化合物Pb、汞以及汞化合物Hg、六价铬化合物Cr6+、多溴联苯PBBs、多溴联苯醚PBDEs 2、卤素氟、氯、溴、碘 3、多环芳烃苯并(a)芘、萘、1-甲基萘、苊烯、苊、蒽、.. 玩具、文具、纺织品及皮革中有害化学物质检测 1、玩具中有毒有害化学物质检测铅、锑、砷、钡、镉、铬、铅、汞、硒、邻苯二甲酸酯、挥发性有机化合物(VOC)含量、苯、甲苯、乙苯和二甲苯等 2、纺织品中有毒化学物质检测重金属含量、水萃取液pH值、有机氯杀虫剂残留量.. 日化产品检测 1、化妆品检测常规项目:甲醛、巯基乙酸、氢醌、苯酚、维生素、氨基酸等 α-羟基酸:酒石酸、乙醇酸、苹果酸、乳酸、柠檬酸等无机物:可溶性锌盐、硼酸和硼酸盐、汞、砷、铅、游离氢氧化物等微生物:细菌总数、粪大.. 环境检测和监测 1、室内空气检测甲醛、氨、苯系物、(苯/甲苯/二甲苯)、总挥发性、有机物(TVOC)、苯并芘、一氧化碳、二氧化碳、二氧化硫、二氧化氮、臭氧、可吸入颗粒物、氡、石材放射性、温度、相对湿度、空气流速、大气压、新风量、菌.. 农药、兽药和肥料检测 1、农药残留检测滴滴涕、六六六等有机氯类;敌敌畏、甲胺磷等有机磷类农药,溴氰菊酯、氯氰菊酯等菊酯类,速灭威、克百威等氨基甲酸酯类,总共400余种的测试 2.兽药残留检测项目硝基呋喃类、染料药物、四环素类、氟.. 医药卫生产品检测 (1)理化指标水分、灰分、红外鉴别、比旋度、密度、净含量等(2)中药、保健食品功效成分总黄酮、肌醇、L-肉碱、原花青素、大豆异黄酮、大蒜素、番茄红素、褪黑素、超氧化物歧化酶(SOD)、灵芝三萜、咖啡因、大黄素、.. 食品、农产品、饲料及食品级接触材料检测 1、食品、农产品、饲料检测(1)理化项目牛磺酸、羟甲基香豆素、三聚氰胺、咖啡因,脂肪酸,明矾,总碱度,L-羟脯胺酸,黄曲霉毒素B1,米酵菌酸,羰基价,甲醛,亚硝酸盐,总脂,二氧化硫,比旋光度,折光率,粒度,细.. 药品报批全项分析和结构确证 中科检测每年为客户提供多项药品报批全项分析和结构确证分析,设备齐全,人员经验丰富,药物结构确证全部顺利通过有关部门审定,是华南地区指定药物化学结构确证分析单位。主要进行的项目有原料药、药物中间体、新药确证.. 再生资源的综合利用鉴定 中国科学院广州化学研究所是广东省资源综合利用产品工艺质量检验省属检测机构,广东省经济和信息化委指定检测机构,负责广东省资源综合利用(可再生资源)产品认定。检测项目: 1.产品和原材料的质量抽检 2.原材料比例.. 未知物剖析(成分分析) 中科检测每年为客户提供多个产品的配方分析,涉及电子、纺织、日化、塑料、橡胶等各个领域,同时提供产品的常规检测及定性、定量分析服务。具体包括以下各类产品:1.高分子及高分子材料 (1)塑料制品塑料粒子、加工母粒、.. 可再生资源 广东省资源综合利用产品工艺质量检验检测机构承诺书 省经济和信息化委、省财政厅、省质监局:本单位是省经济和信息化委、财政厅、质监局联合公布的广东省资源综合利用产品工艺质量检验检测机构,为配合资源综合利用.. 危险品运输条件鉴定 货物运输条件鉴定 2008-8-3 为了运输的安全,航空运输、公路运输、铁道运输、水路运输都必须了解货物的运输危险性。货物运输条件鉴定就是对货物的运输适宜性作出评价和建议。货物运输条件鉴定一般依据IATA危险货物规章(DG.. 企业危险物排放检验 危险品鉴定业务:依据联合国《关于危险货物运输的建议书》(橙皮书)、国际民航组织《危险物品航空安全运输技术导则》(ICAOTI导则)、国际航空运输协会《危险品规则》(IATADGR)、国际海事组织《国际海运危险货物规则》.. 提供新的测试项目和方法建立、配方研制以及产品开发 可根据客户要求,提供一些新的测试项目和方法建立、配方研制以及产品开发等。 高分子材料的老化试验 高分子材料的老化试验。 热塑性高聚物熔体流动性质和熔体流动速率 热塑性高聚物熔体流动性质和熔体流动速率。 高分子材料的拉伸强度、弯曲强度、压缩强度等测定 高分子材料的拉伸强度、弯曲强度、压缩强度、冲击强度、弹性模量、弯曲模量和硬度测定。 高分子材料的马丁耐热性能、热变形温度和维卡软化点温度测定 高分子材料的马丁耐热性能、热变形温度和维卡软化点温度测定。 介电常数、损耗因子、固化度、固化速率、离子导电率、次级转变温度和聚.. 介电常数、损耗因子、固化度、固化速率、离子导电率、次级转变温度和聚合物相态。 高分子材料的燃烧性能分析 高分子材料的燃烧性能分析。 高分子材料熔体的流变性能、加工性能和平行扭矩 高分子材料熔体的流变性能、加工性能和平行扭矩。 各种材料、化工产品、药物的分解温度及失重量 各种材料、化工产品、药物的分解温度及失重量。 含水材料的结合水量及非结合水量 含水材料的结合水量及非结合水量。 蛋白质的变性温度、变性热 蛋白质的变性温度、变性热。 液晶的相变温度、相变热 液晶的相变温度、相变热 热固型树脂的固化温度、固化热、固化反应动力学 热固型树脂的固化温度、固化热、固化反应动力学。 聚合物玻璃化转变温度、熔点熔化热等 聚合物玻璃化转变温度、熔点熔化热、结晶温度、结晶热、结晶动力学。 聚合物共混物的相分析 聚合物共混物的相分析。 各种物质颗粒形貌观察、粒径大小及分布 各种物质颗粒形貌观察、粒径大小及分布。 高分子材料、纤维的结晶度、晶粒大小的测定 高分子材料、纤维的结晶度、晶粒大小的测定。 有机物、无机物、矿物的晶型分析 有机物、无机物、矿物的晶型分析。 脂溶性及水溶性高分子分子量及分子量分布 脂溶性及水溶性高分子分子量及分子量分布。 工商注册和货物运输安全检查报告书 工商注册和货物运输条件鉴定书所需的安全检查报告书(我中心是广东省危险化学品登记注册办公室指定测试单位)。 化工产品的灰分、PH值、密度等检测 化工产品的灰分、PH值、密度、闪点、燃点、粘度、水份、酸碱度、环氧值、折光率和旋光度等检测。 无机阴离子定性定量分析 无机阴离子(F-、Cl、、Br-、I-、NO2-、NO3-、PO43-、SO42-等)和有机阴离子(甲酸根、乙酸根、柠檬酸根、酒石酸根等)定性定量分析。 金属元素含量分析 金属元素(Ag、Au、Ca、Cd、Cr、Cu、Al、Fe、K、Na、Mg、Pb、Pd、Pt、Zn、Ni、Sb、Li、Mo、Se、Ti、Co等)含量分析。 多糖的含量测定 多糖的含量测定。 有机物含量测定 有机物含量测定,药物:丙酸氯倍他索、醋酸氟氢松、倍他米松二丙酸酯、对乙酰氨基酚、VC、盐酸二甲双胍、氯氮平等;农/兽药:草甘膦、多菌灵、喹烯酮等;天然产物:叶黄素、大豆异黄酮、厚朴酚等;食品添加剂:牛磺酸、苯甲.. 有毒有害物质及限制性物质的定量分析 6、各种产品中有毒有害物质及限制性物质(重金属:PbCdCrHgAs、农药残留物及恶臭成份、食品添加剂、挥发性有机物、阻燃剂、多环芳烃、邻苯二甲酸酯、多溴联苯、多溴联苯醚、偶氮燃料、己二酸酯、有机锡、甲醛等)的定量分析.. 物残留物质含量的测定 聚合物残留物质含量的测定 一维氢谱、碳谱(含DEPT)、磷谱、硅谱等检索 一维氢谱、碳谱(含DEPT)、磷谱、硅谱等;二维H-HCOSY、NOESY、H-CCOSY、HMBC等;核磁图谱解析和碳谱谱图检索 药品报批全项分析 药品报批全项分析 有机物、天然产物的结构分析和鉴定 有机物、天然产物的结构分析和鉴定 化工原料、产品等各种成份定性定量分析 化工原料、化工产品(塑料、橡胶、纤维、树脂、粘合剂、涂料、水处理剂、表面活性剂、食品添加剂、润滑剂、燃料、有机溶剂和各种助剂等)、天然挥发性产物、矿物和石油化工产品等各种成份定性定量分析。 ★ 优势学科领域:
天然资源化学增值研究,环境友好高分子材料,纳米材料与精细化工材料,电子有机聚合物材料,化学灌浆材料与工程技术,有机合成与天然产物化学,药物合成化学。
★ 招生专业:
我所是学位委员会1981年首批批准的硕士学位授予单位,2001年经批准招收博士研究生。属国民教育系列之普通高等学校,学历学位证书国家予以承认。
招收学术型研究生专业:化学博士一级学科(高分子化学与物理、有机化学)专业、化学工程与技术硕士一级学科(应用化学)专业,及有机化学、高分子化学与物理硕士专业。
招收全日制专业学位硕士研究生专业:材料工程、化学工程。
★办学特色:
我所已有34年研究生培养历史,定位以应用研究为主。研究所既是研究中心,又是高新技术成果产业化基地,研究生教育秉承“少而精”的特色,重点培养高端复合型专业人才,许多毕业生现已成为全国应用领域各行各业的领导和骨干力量。
我所研究生培养方案符合当今国家人才战略导向,学生在从事学位论文课题研究的同时,还可在导师指导下直接与企事业单位进行研发项目合作研究,既培养学生科研能力,又锻炼其解决实际问题本领。学生通过成果产业化基地平台,理论衔接实际,积累专业工作经验,为就业奠定良好基础,近年来我所毕业生就业率一直保持在95%以上。
★在学研究生待遇:
提供助学(研)金。对优秀学生设立广州化学所研究生奖学金奖,根据单位业绩学生可不定期享受绩效津贴。学生宿舍每间2人,内有独立卫生间,配置热水器、电话及宽带网接口。
热忱欢迎各大高校应历届硕士毕业生报考我所。
撒隆巴斯进口和国产区别
晶云药物科技有限公司(Crystal Pharmatech)是首家置身中国面向全球的药物晶型与固态研发公司,致力于为制药行业提供高质量、高效率、高信誉的药物晶型与固态研发领域的专业技术服务。核心业务集中在以药物的固态信息为中心的专业领域,包括原料药及其中间体的盐类,共晶和多晶的筛选和评估,原料药和制剂的专业表征和评估,药物结晶工艺的优化和放大,临床前药物制剂的研发,以及上述相关领域内自主知识产权技术和产品的开发,高级技术咨询及其培训等。 1.新药/仿制药晶型的筛选、评估和优化
2.晶型稳定性相图研究
3.溶解度测定
4.稳定性研究(化学/物理)
5.理化性质测定(pKa, LogP/logD, 密度, 粒度分布, XRPD, DSC, TGA, DVS, BET, Raman, FT-IR)
6.给药系统选择风险评估
7.早期制剂开发 1.固态核磁/拉曼
① 歧化反应
② 晶型转变
③ 无定形药物
2.原料药和辅药的相容性研究
3.非传统制剂的研究
① 纳米悬浮液
② 固态分散制剂 1.药物化学提纯
2.药物手性拆分
3.多晶型体系中的单一晶型的生产
4.产物颗粒大小分布、形态、等物理性质的控制
5.物化特性优良的无定型颗粒的制备
6.工艺的可重复性,产品质量属性优化工艺的可控性
7.工艺过程设计空间的科学建立
8.工艺过程分析技术(PAT)的合理应用药物固态研究 1.单晶培养和结构解析
2.各种固态表征
3.原料药和制剂中的晶型检测和定量分析
4.无定形定性和定量分析
求助:检验方法验证或确认的风险评估
撒隆巴斯进口和国产的区别有价格不同、质量标准不同和辅料质量、原料药不同。
1、价格不同:由于进口药物的成本和关税占据很大一部分,所以药物费用也比较高。
2、质量标准不同:现今的国产药和进口药已经没有明显的区别,部分药物还以国产的质量最好。不过也有少数药物,进口药物和国产药物,因为生产工艺不同,效果上存在一定差异。
3、辅料质量、原料药不同:原料药晶型不同、纯度不同,其溶解度、稳定性不同。国产与进口没有绝对的孰好孰坏,主要取决于制药工艺,比如有些头孢类药物因无法严格控制杂质含量需要做皮试,而制作工艺较好的药物则不需要做皮试。
为什么硝苯地平有关物质测定检测不到杂质峰
对于生产工艺而言,采取有效手段监测日常生产中有可能发生的,与经过验证的产品注册工艺的偏离,并评估是否有必要采取措施加以预防或纠正,确保工艺处于监控中;持续收集和分析日常生产中与产品质量相关的工艺数据以判断产品的关键质量属性在整个工艺过程中受控状况;通过产品质量年度回顾对质量缺陷投诉、OOS数据、偏差、收率波动等变化情况进行趋势分析并评估工艺过程是否处于受控状态。
对于厂房、设施、设备而言,通过日常例行监测、维护与校验程序及计划与实施来保持确认状态;通过对日常获得数据与设施及设备确认数据的定期评估确定是否需要再确认或再确认的程度。
对于清洁而言,验证状态的维护应包括环境监测数据趋势分析;必要时对与物料直接接触的设备表面进行残留物检测(新版GMP第197条-六);设备(包括被清洁设备和用于清洁的设备)的预防性维护和校准等。
总之,应采用风险管理的原则,根据实际需要选择验证状态维护工具。
新版GMP第一百四十条特别强调了确认与验证的实施要有文件、有记录、有目标。明确要求厂房、设施、设备的设计要符合预定用途及GMP要求,建造安装要符合设计标准,运行符合设计标准,在正常操作方法和工艺条件下其性能可持续符合标准;生产工艺按规定参数能持续生产出符合预定用途和注册要求的产品。
设计确认(DQ)是新的或改造的厂房、设施、设备验证工作的第一步,内容主要包括为了确认设施、系统和设备的设计方案符合期望目标所作的各种查证工作及文件记录。
按照新版GMP《确认与验证》附录规定,企业首先需要以文件的形式向供方提供“用户需求说明(即URS)”。
通俗地说,客户需求文件(URS)就是设计确认的检查标准。它是验证工作获得成功基础,有了URS才能有目标地展开验证活动。
在给供应商提供的URS中,企业要立足于产品与工艺需要,明确提出自己对厂房、设施、设备等的使用要求(预定用途)以及其它相关法律法规符合性要求。尽而对供方所“提供”的厂房、设施、设备设计方案及说明性资料进行预审查,避免设计失误造成无法弥补的先天性缺陷。
经生产质量等相关负责人审核、批准的用户需求说明(URS)应尽可能做到:每一个需求都有具体的标准;每一个需求都能够通过测试或确认来证实供方提供的实物是否满足自己的需要;每一个需求都清楚明确而且是能够实现的;每一个需求都通过设计和测试进行追踪。
在进行设计确认时,要重点关注与质量相关的关键点。如材料材质、安全评估、环保问题、空间要求、使用要求;设计是否易于清洗/清洁与检查;是否引入有害的物料及需要更换的部件等。
目前,还没有一个行业内普遍认可的设计确认模式。实际工作中,如果从项目实施开始就按照国家关于医药建筑、设备等的相关规定操作,将满足这些规定的全套资料保存下来,就基本符合了新版GMP对设计确认的检查要求。如果设备是定制的话,则更需要加强设计确认。
另外,在设计确认阶段应强化变更管理,对原设计的任何变更都要进行记录,并对相关因素作出适应性调整。
安装确认(IQ)是为了证明新的或改造的厂房、设施、设备达到设计要求而进行的各种系统检查及将技术资料文件化的工作。
企业应当根据用户需求和设计确认中的技术要求对厂房、设施、设备进行验收并记录。安装确认至少包括:根据最新的工程图纸和技术要求,检查设备、管道、公用设施和仪器的安装是否符合设计标准;收集及整理(归档)由供应商提供的图纸、设备清单、各类证书及材质证明、说明书或操作与维护保养手册;对相应的仪器仪表进行必要的校准;工程技术人员根据供方提供的技术资料结合本企业实际情况,起草操作、清洁、校准和维护保养等标准操作规程。
运行确认(OQ)是为了证明新的或改造后的厂房、设施、设备能在设计要求预期的范围内正常运行而作的试车、查证及文件化工作。
运行确认至少包括:根据设施、设备的设计标准制定运行测试项目;试验/测试应在一种或一组运行条件之下进行,包括设备运行的上下限,必要时采用“最差条件”进行确认,而且测试要重复足够的次数以确保结果可靠;操作、清洁、校准和预防性维护保养等操作规程应在运行确认过程中进行修改和完善,并对相关人员培训。
安装确认与运行确认一般可以由供应商与企业共同完成。完成了运行确认相当于允许厂房、设施、设备正式“放行”使用。?
性能确认(PQ)是为了证明已安装连接的厂房、设施、设备能够根据批准的生产方法和产品的技术要求有效稳定(重现性好)运行所作的试车、查证及文件化工作。
性能确认是使用生产物料、经确认的替代品或模拟产品,对每一个关键控制系统(如温度控制、压力控制和搅拌控制等)和所有影响产品质量的关键参数(如温度、压力和搅拌速度等)进行的测试。性能确认方案内容包括参数介绍、测试条件和方法、测试的频率及其标准等,应当评估测试过程中所需的取样频率。
在性能确认阶段,对于制剂产品而言,为了证实设备能够满足商业化生产的能力,会在正式生产之前生产一些空白产品。而对于原料药来讲,很难在生产中使用所谓的空白物料。有些公司会运行溶剂或水来模仿原料药工艺(以水代物料,与试车工作相结合)。也可以采用投入正规生产时所用物料进行性能确认,将该批次产品同时定义为工艺验证批和设备性能确认批(企业承担批次失败所带来的经济损失风险)。
确认工作过程要有逻辑性和系统性,一般均为先向供方提出URS,然后是DQ、IQ、OQ、PQ。在某些情况下,可以考虑采用性能确认和运行确认或工艺验证结合进行的方式,但应有充分的说明,性能确认过程的取样频率需要评估。
厂房与设施(含空气净化系统,压缩空气系统、制水系统等)应先于设备进行确认,设备确认应在投入正常生产前完成,因为生产设备应当在确认的参数范围内使用(见新版GMP第八十三条)。与确认相关的文件记录包括标准操作规程、可接受标准、操作手册等。确认应按照已批准的方案进行,确认结果应记录并反映在确认报告中。
如果确认对象是已经在使用的,应针对实际现状予以确认:进行安装现状检查(IQ)、设备运行参数检查测试(OQ)、与工艺匹配性测试评估(PQ)即可。
确认是工艺验证的先决条件,厂房、设施、设备的确认应列入验证总计划中。
工艺验证(PV)的主要目标是认定所设计的生产工艺按照规定的工艺参数能够持续生产出符合预定用途和注册要求的产品。
药品上市销售前必须完成并达到设定要求的工艺验证。新版GMP特别强调采用新的产品处方或生产工艺前应当验证其常规生产的适用性,以确保“能够始终生产出符合预定用途和注册要求的产品”(见第一百四十一条)。这里的“预定用途和注册要求”,即指药品疗效、安全性和质量标准的符合性。
工艺验证首先基于从研发过程中获得的对产品和工艺知识的理解,以重点识别和关注产品的关键质量属性(可从鉴别、理化性质、性状、含量、纯度、粒度、微生物限度、晶型等方面考虑)、关键工艺参数、常规生产和工艺控制中的关键工艺参数范围。采用新的生产处方或生产工艺进行首次工艺验证应当涵盖该产品的所有规格。
中国药典的特点
如何建立薄层色谱法测定有关物质的方法
有关物质是研究药品中除主成分以外的杂质,它可能是原料药合成过程中带入的原料、中间体、试剂、降解物、副产物、聚合体、异构体以及不同晶型、旋光异构的物质,也可能是制剂过程中产生的降解物,或是在贮藏、运输、使用过程中产生的降解物等。这些杂质的存在直接反映药品的有效性和安全性,故要对其进行研究,特别是在药品申报的质量研究资料中需建立其检测方法,并根据生产、稳定性考核等实际情况考虑是否在质量标准中制订该检查项,规定其限度。目前,有关物质的常用测定方法有高效液相色谱法(HPLC法)和薄层色谱法(TLC法)。
1.测定方法类型
常用的方法有杂质对照品法(适用于已知杂质)和自身(稀释)对照法(适用于一般杂质检查,杂质成分少且尚不能取得杂质对照品)。目前国内由于难以获得杂质对照品、故一般均采用自身对照法。
2.展开剂的确定(即专属性试验)
专属性的研究是提供被分析物在杂质和辅料存在时能被区分的证明,该点是色谱条件建立的关键。通常采用在被分析物的对照品或精制品中加入一定量的杂质或辅料,证明色谱条件可将各杂质与被分析物分离[1]。这里的关键是:将多少量的杂质加入到多少量的主成分中。正确的作法是将1%(w/w)浓度量的各杂质加入到100%浓度的主成分中,配制这样的溶液来
验证系统适用性。之所以如此配制,目的是模仿样品中有可能存在的状态,即有少量(1%左右)杂质存在时是否能与主成分达到完全分离,只有这样才能比较客观、科学地反映样品中实际存在情况的(见图1);而不应把该溶液配制成:主成分与中间体相同浓度的。因为一者实际检测时样品中不可能存在此种情况;二者该浓度不易确定,目前国内申报资料中一般的作法均是配制成较低的一致浓度,这样各斑点当然易于完全分离了,但在实际测定时,由于主斑点急剧增大,很易将相邻杂质包含于主成分斑点中。同样,质量标准中的系统适用性试验用溶液的配制方法亦如此。
3.检出条件的确定
其基本出发点是:主成分与相关杂质均应在该条件下显色,且在相同浓度下,斑点大小应基本一致。薄层板的类型根据被测物质的性质来选用,测定有紫外吸收的物质通常选用GF254或GF365板;测定无紫外吸收、需喷显色剂的,常选用硅胶G板或H板,选用该类薄层板时,显色方法根据被测物质的结构式选取,但当有多个显色方法时,应分别进行试验,选取灵敏度最高的显色方法。如醋酸氢化可的松有关物质的测定,中国药典2000年版采用碱性四氮唑蓝试液显色,美国药典26版采用硫酸-乙醇(10:90)溶液显色,两者均为激素类药物的显色方法。醋酸氢化可的松属于激素类中的肾上腺皮质激素,四氮唑法是肾上腺皮质激素的重要显色方法;而硫酸-乙醇显色法则主要是针对激素类中的雌激素的显色反应,对于属于肾上腺皮质激素类的醋酸氢化可的松则反应活性不强,结果两法的灵敏度相差10倍以上。因此,检出条件的确定,一定要在查阅文献的基础上,并根据试验结果进行综合考虑。
4.供试品溶液浓度的确定(灵敏度试验——最低检出限的测定)
供试品溶液浓度的设定在有关物质检测中是至关重要的,浓度越高、越能反映样品中杂质存在的情况,但若设定得过高,则会产生主斑点严重拖尾、“断腰”等超载现象的发生,产生错误结论;若设定太低,又将达不到检测杂质的目的,观测不到杂质量的变化。其设定是根据最低点样量和最大点样量来综合考虑的。
最低检出限虽然是个绝对值,但真正的意义却是其相对值,即相对于供试品溶液的浓度多少而言,所以测定结果不仅要罗列出其绝对值又应列出其相对值,这样最低检出限才有意义!最大点样量则是通过不断加大供试品溶液浓度,直至主斑点严重拖尾、“断腰”等情况出现时来得到的。然后根据最低检出限,采用“上推法”来确定:如一般设定杂质斑点小于1.0%对照斑点,对照溶液的浓度至少应为最低检出浓度(即最低检出限)的20~50倍,则供试品溶液浓度是最低检出浓度的2000~5000倍;反过来,最低检出浓度应至少达到供试品溶液浓度的0.02%~0.05%。应注意的是:由于最低检出量和最大点样量因试验环境、薄层板质量以及即时试验时其他各因素的不同而改变(即耐受性因数),故供试品溶液的浓度在保证小于最大进样量的情况下,可在此基础上设定得再高一些,以保证该浓度可适用于各种条件下。。
《中国药典》2015年版第一个重要特点是,将上一版药典中药、化学药、生物制品三部分别收载的附录(凡例、制剂通则、分析方法、指导原则、药用辅料等)三合一,独立成卷作为第四部(收载通则总数317个,其中制剂通则38个,检测方法240个,指导原则30个,标准物质和对照品相关通则9个;药用辅料收载270种,其中新增137种、修订97种),制定了统一的技术要求,以解决长期以来各部药典收载的方法、通则重复收录,不协调、不统一、不规范等不足,使分类更加清晰明确,药典标准更加系统化、规范化。
同时,扩大现代分析技术的应用,进一步将先进、成熟的检测技术应用到药品检验中,建立了灵敏度高、专属性强、稳定性好的检测方法。比如,为加强对中药材残留农药的控制,完善了原有的气相色谱法,将农药残留检测种类由原来的9种增加到可以检测22种;建立气相色谱-串联质谱法和液相色谱-串联质谱法,将可检农药残留种类能力提高到229种。此外,还增加了国家药品标准物质、药包材通则和指导原则,形成了涵盖原料药及其制剂、药用辅料、药包材和标准物质的药品标准体系。
第二个特点是增加了检测药品的限量指标,进一步提升了药品安全保障水平。
在中药方面,《中国药典》2015年版系统构建了中药安全性控制体系,控制范围涵盖了二氧化硫残留、重金属及有害元
2、彰显四大特点
素、农药残留量、真菌毒素、色素、内源性有害物质、微生物、致病菌等;完成了67个中成药薄层色谱检测项中展开剂中毒性溶剂的替换工作;制定了中药材及饮片中二氧化硫残留量限度标准;建立了珍珠、海芹等海洋类药物标准中有害元素限度标准;制定了人参、西洋参标准中增加有机氯等16种农药残留的检查;对柏子仁等14味易受黄曲霉毒素感染药材及饮片标准中增加了“黄曲霉毒素”检查项目,并制定相应的限度标准等。
在化学药方面,加强杂质定性和定量测定方法的研究,实现对已知和未知杂质的区别控制,优化了抗生素聚合物测定方法;设定合理的控制限度;加强对包括催化剂在内的无机杂质检测方法的研究与修订,提高了方法的准确性,如雷米普利原料药中采用原子吸收光谱法对合成工艺中使用的催化剂钯进行检查;针对剂型特点设置了安全性项目,如静脉输液及滴眼液的渗透压控制,大输液增加细菌内毒素检查,乳状注射液增订乳粒大小检查等。
在生物制品方面,增加了单克隆抗体总论、疫苗总论和生物技术产品总论,增订“生物制品生产用原辅材料质量控制通用性技术要求”;制定了产品关键指标限度,如疫苗制品增订渗透压摩尔浓度检测,生产用种子批规定进行基因序列测定;加强有机溶剂残留以及产品中杂质的控制,建立了生产用宿主细胞DNA和蛋白残留量检测方法及其限度。
特点之三是增设了专属性检验项目设定,药品有效性控制能力进一步加强。
在中药方面,《中国药典》2015年版对部分中药材增加了显微鉴别检查;对中药材加强了专属性鉴别和含量测定,如采用LC-LC-MS对胶类药材进行鉴别,采用PCR检测方法对川贝进行鉴别检查,对某些中药材增加特征氨基酸的含量测定等;对六味地黄丸系列品种建立了主要成分-莫洛苷的检测方法;建立了丹参、沉香、枣仁安神胶囊等30多个应用指纹特征图谱等。
在化学药方面,增加了对制剂有效性指标的设置;完善溶出度和释放度检查法,加强对常释口服固体制剂和缓控释制剂有效性的控制;加强肠溶制剂释放度和耐酸力、治疗胃酸药品的制酸力的控制;增加了难溶性晶型原料药的粒度、注射剂的复溶时间等指标的控制;加强专属性强、适用性广的方法学研究用于制剂含量测定;加强了与放射品活性相关的检查方法研究和增订。
在生物制品方面,进一步提高了效力测定方法的规范性、准确性和可操作性。
特点之四是完善了药用辅料标准,进一步提高了药物制剂质量。《中国药典》2015年版新增药用辅料品种139个,修订95个,收载总数达270个,收载品种增加105%,修订数量占总品种的70%,覆盖面广泛。如收载了聚山梨酯80(供注射用)、聚乙二醇300、聚乙二醇400以及可溶性淀粉、二氧化碳、活性炭等适用范围广泛的辅料。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。












