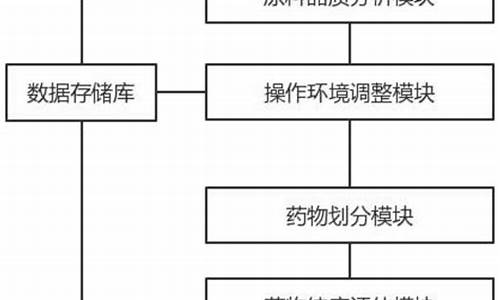
原料药 api-原料药和api的区别是什么的区别

具体的原料药加工后——药物制剂
原料药的称呼主要相对于制剂来说的。
以化学加工手段获得的原料为主,供应生产成品药的原料
比如注射用硫酸头孢匹罗是药,那么硫酸头孢匹罗就是原料药
原料药是指什么
根据权威调查机构发布的国内化学药制品市场分析报告指出,2013年化学制药工业经济运行情况不容乐观,但增长情况仍值得期待。创新型企业将带动本产业转型升级。此外,随着化学制药工业电子务的发展,入驻交易平台成为创新型企业的必经之路。传统的原料药发展受限,转型升级需择路而行,随着深圳创新型企业入驻南方交易平台,越来越多的原料药供应商也开始了自己的电商之路。 中国是原料药生产大国,2012年原料药产量为136万吨,同比增长了9.05%,产量位居世界第一。规模效益的取得得益于中国生产的低成本和环境的污染,在目前我国物价普遍上涨,环保管理不断加强的情况下,行业发展的成本优势变的不明显。
在国际上,中国最大的竞争对手印度,虽然其在行业发展的规模上不如中国,但在成本优势和行业发展速度上都比中国有明显的优势。 我国现有医药企业8700多家,通过GMP的医药生产企业6000多家,在国家食品药品监督管理局注册的原料药生产企业共有3000多家,医药中间体的生产企业也占较大比例,
2008年,中国原料药进出口总额238.94亿美元,同比增长22.19%,占我医药进出口总额的49.07%。
从2008年至今,我国原料药出口年均复合增长率超过20%,2009出口额达到175.8亿美元,同比增长29.59%。出口对原料药工业的拉动作用越来越明显和重要,直接促进了行业利润水平的提高,2012年1-11月,原料药实现利润155.9亿元,增幅高达49.5%。 第一,受金融危机的影响,国际买家资金紧张,购买力下降或购买周期延长,不仅影响了中国原料药的销售量,而且增大了出口企业的经营风险。
第二,价格暴涨暴落加重了国际买家的担心和观望,影响了原料药行情的平稳发展。
第三,部分原料药价格增幅较大,造成企业扩大产能的冲动,加剧了市场供过于求的矛盾。
第四,主要出口目的国和竞争对手国的货币贬值,降低了中国原料药的价格竞争力,加大了出口难度。第五,金融危机促使国际贸易保护主义加剧,使中国部分出口市场环境进一步恶化。 首先,全球药品市场2014年将有望保持8%以上的增幅,新兴医药市场有可能保持更大的增幅,原料药的国际国内市场需求将继续呈增长态势。
其次,中国的许多原料药品种在国际市场占有较高的市场份额,规模优势明显,短期内其它国家无法替代。
第三,虽然因多重因素的影响,中国原料药的价格有较大上涨,但这些上涨因素是刚性的,2013年不可能大幅下降并影响到中国原料药的出口总额。从2012年原料药进口情况看,均价上涨了28.21%,在全球原料药价格普遍上涨的情况下,中国原料药价格的比较优势依然存在。
第四,中国企业避免同质化竞争,发展特色原料药的努力,和众多企业瞄准发达国家市场,积极通过高端市场认证,不断提高出口产品质量的做法,将拓展中国原料药的出口空间。
第五,国家鼓励出口政策的不断出台和落实,也将对原料药的出口增长起到重要的推动作用。
摘要:原料药指的是用于生产各类制剂的原料药物,是无法直接服用的物质。有的人常常把它和中间体混淆,两者还是有一定不同的,原料药和中间体的区别在于定义方面、认证方面、新药开发的角度、药事管理角度等方面上。具体的原料药是指什么以及原料药和中间体的区别在哪里,一起到文中来看看吧!一、原料药是指什么
原料药,指用于生产各类制剂的原料药物,是制剂中的有效成份,病人无法直接服用的物质。
原料药在ICHQ7A中的完善定义:旨在用于药品制造中的任何一种物质或物质的混合物,而且在用于制药时,成为药品的一种活性成分。此种物质在疾病的诊断,治疗,症状缓解,处理或疾病的预防中有药理活性或其他直接作用,或者能影响机体的功能或结构。
二、原料药和中间体的区别在哪里
1、定义不同
(1)中间体:Intermediate:原料药工艺步骤中产生的、必须经过进一步分子变化或精制才能成为原料药的一种物料。中间体可以分离或不分离。
(2)原料药:ActivePharmaceuticalIngredient(API)(orDrugSubstance)_活用成分:旨在用于药品制造中的任何一种物质或物质的混合物,而且在用于制药时,成为药品的一种活性成分。此种物质在疾病的诊断,治疗,症状缓解,处理或疾病的预防中有药理活性或其它直接作用,或者能影响机体的功能和结构。
从定义中可以看出,中间体是制作原料药的前道工序的关键产物,与原料药结构不同。另外,药典中有原料药的检测方法,但是没有中间体的。
2、认证方面的区别
(1)中间体(FDA)目前FDA要求中间体必须进行注册,CEP则不用,但是CTD文件中要有中间体的详细工艺描述。而国内,对中间体没有GMP强制要求。
(2)原料药(API)由API企业提交的,如果API合成路线非常简单,如只有一步反应,FDA认为风险控制不足,就非常有可能去延伸检查中间体。中间体管理一般按照ISO或者结合Q7a,有质量体系管理就可。
3、从新药开发的角度说
(1)原料药是经过充分药学研究可以安全的用于人体起治疗诊断作用的一个化合物。
(2)中间体是合成原料药过程中的化合物,不一定具备治疗作用或者有毒性。注意,这里说的是不一定,有些原料药合成过程中的中间体也是原料药。
4、从药事管理的角度说
(1)原料药要依法向药监当局(在中国是国家食品药品监督管理总局,在美国是FDA,在欧洲是EMA)申请注册,取得批准文号后在符合GMP的厂房中合成。
(2)中间体只是合成原料药过程中的中间产物,不需要取得文号。需要说明的是与原料药同样的化合物没有取得文号或者不是在GMP厂房中生产都不是原料药。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。