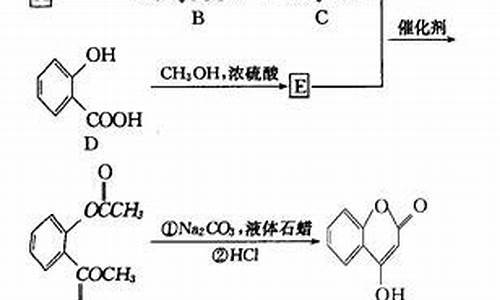
原料药仓库温湿度要求标准-药品库的温湿度要求

药品的特殊性包括药品是是以人为使用对象,预防、治疗、诊断人的疾病。有目的地调节人的生理机能,有规定的适用症、用法和用量要求。药品不是一种独立的商品,它与医学紧密结合,相辅相成。患者只有通过医生的检查诊断,并在医生与执业药师的指导下合理用药,才能达到防止疾病、保护健康的目的。
根据《中华人民共和国药品管理法》第四十一条 药品监督管理部门对下列药品在销售前或者进口时,指定药品检验机构进行检验;检验不合格的,不得销售或者进口:
(一)药品监督管理部门规定的生物制品;
(二)首次在中国销售的药品;
(三)规定的其他药品。
前款所列药品的检验费项目和收费标准由财政部门会同价格主管部门核定并公告。检验费收缴办法由财政部门会同药品监督管理部门制定。
第四十一条 药品监督管理部门对下列药品在销售前或者进口时,指定药品检验机构进行检验;检验不合格的,不得销售或者进口:
(一)药品监督管理部门规定的生物制品;
(二)首次在中国销售的药品;
(三)规定的其他药品。
前款所列药品的检验费项目和收费标准由财政部门会同价格主管部门核定并公告。检验费收缴办法由财政部门会同药品监督管理部门制定。
根据《中华人民共和国药品管理法》第一百条 本法下列用语的含义是:
药品,是指用于预防、治疗、诊断人的疾病,有目的地调节人的生理机能并规定有适应症或者功能主治、用法和用量的物质,包括中药材、中药饮片、中成药、化学原料药及其制剂、抗生素、生化药品、放射品、血清、疫苗、血液制品和诊断药品等。
辅料,是指生产药品和调配处方时所用的赋形剂和附加剂。药品生产企业,是指生产药品的专营企业或者兼营企业。药品经营企业,是指经营药品的专营企业或者兼营企业。
扩展资料:
《中华人民共和国药品管理法》第四十一条 药品监督管理部门对下列药品在销售前或者进口时,指定药品检验机构进行检验;检验不合格的,不得销售或者进口:
(一)药品监督管理部门规定的生物制品;
(二)首次在中国销售的药品;
(三)规定的其他药品。
前款所列药品的检验费项目和收费标准由财政部门会同价格主管部门核定并公告。检验费收缴办法由财政部门会同药品监督管理部门制定。
百度百科——中华人民共和国药品管理法
无尘车间如何设计
药品生产管理流程
管理是人类各种组织活动中最普通和最重要的一种活动。以下是我收集的药品生产管理流程,欢迎查看!
批生产记录批
生产记录是一批药品生产各工序全过程(包括中间控制)的完整记录,应具有质量的可追踪性。
一、批
批的概念:在规定限度内具有同一性质和质量,并在同一连续生产周期中生产出来的一定数量的药品为一批。
1. 大、小容量注射剂一般以同一配液罐一次所配制的药液所生产的均质产品为一批。
2.粉针剂一般以同一批原料药在同一连续生产周期内生产的均质产品为一批。
3.冻干粉针剂以同一批药液使用同一台冻干设备在同一生产周期内生产的均质产品为一批。
4.固体、半固体制剂在成型或分装前使用同一台混合设备一次混合量所生产的均质产品为一批。
固体制剂如采用多次混合后的产品作为一个批号,必须经过验证,证明产品质量的均一性后,在规定限度内所生产的产品为一批。一般以最终所采用的混合设备如多维运动混合机混合一次的数量为一个批次。
5.液体制剂(包括膏滋、浸膏及流浸膏等)以灌封(装)前经最后混合的药液所生产的均质产品为一批。
6.连续生产的原料药,在一定时间间隔内生产的在规定限度内的均质产品为一批。
间歇生产的原料药,可由地定数理的产品经最后混合所得的在规定限度内的均质产品为一批。混合前的产品必须按同一工艺生产并符合质量标准,且有可追踪的记录。
7.生物制品生产应按照中国生物制品规程中的“生物制品的分批规程”分批和编制批号。
应注意两台或两台以上的压片机(胶囊充填机)所压制出来的片子,必须分别做片重差异(装量差异)检查,确认在同一合格的范围之内并且符合其质量要求后才可作为一批。
二、批号
批号的定义:用于识别“批”的一组数字或字母加数字,用以追溯和审查该批药品的生产历史。生产中的每一个批次都必须要编制生产批号。
批号的编制方法
1. 正常批号:年—月流水号,如011201批,即2001年12月的第1批。或采年—月—日流水号,如0112012批,即2001年12月1日的第二次配制所生产的批号。或采用数字加字母,以英文字母表示生产车间或剂型等。
2. 重新加工批号:重新加工后的批号不变,只是在原批号后加一代号以示区别,代号由企业自定,如年—月—日流水号(代号)。
3.混合批号:年—月—流水号(代号),如0112/03-05,表示所混合的批号为2001年12月第3批至第5批共3 批,代号由企业自定,并由车间填写混合批号登记表。
应注意的是药品的零头包装只限于两个批号为一合箱,合箱外应标明全部批号,并建立合箱记录。
三、批生产记录
1.批生产记录的定义:一个批次的待包装品或成品的所有生产记录。批生产记录应能提供该批产品的生产历史、以及与质量有关的情况。
2.批生产记录的内容:产品名称、生产批号、生产日期、操作者、复核者的签名、有关操作与设备、相关生产阶段的产品数量、物料平衡的计算、生产过程的控制记录及特殊问题的记录。
3.批生产记录的填写
岗位操作记录由岗位操作人员填写,岗位负责人、工艺员审核并签字;批生产记录由车间技术人员汇总,车间技术主任或车间专职工程师审核签字,跨车间的产品,各车间分别填写,由厂生产技术部门指定专人汇总审核并签字。成品发放前,厂质量管理部门审核批生产记录并签字,决定产品的最后放行。
GMP中规定填写批生产记录应字迹清晰、内容真实、数据完整,并由操作人及复核人签名。记录应保持整洁,不得撕毁和任意涂改,更改时,在更改处签名,并使原数据仍可辨认。
填写批生产记录的要求:
①内容真实,记录及时;
②字迹清晰,不得用铅笔填写;
③不得任意撕毁和涂改,需要更改时,应用一条或二条横线划在更改处,在旁边重写正确的数据并签名及日期,要使原数据仍可辨认;
④按表格内容填写齐全,数据完整,除备注栏外,不准留有空格,如无内容可填写,要用“—”表示;
⑤内容与前面相同时应重复填写,不得用“……”或“同上”、“同左”来表示;
⑥品名等应写全名并按标准名填写,不可简写;与其他岗位、班组或车间有关操作记录应做到一致性、连贯性;
⑦填写日期一律横写,不得简写;
⑧签名时应写全名,不得简写;
⑨数据的修约应采用舍进机会相同的修约原则,即“4”舍、“6”入、“5”成双。
4.复核批生产记录的注意事项:
必须按每批岗位操作记录串联复核;
必须将记录内容与生产工艺规程,岗位操作规程对照复核;
上下工序及成品记录中的数量、质量、批号、容器号必须一致、正确;
对生产中不符合要求的填写方法,必须由填写人更正并签字;
若发现异常情况必须查明原因,作出合理的说明,并作详细的记录,经办人,复核人要签字。
5.批生产记录的保存:
批生产记录应按产品种类按批归档保存至产品有效期后一年,未规定在效期的药品,其批生产记录至少应保存三年。
生产过程的技术管理
一、生产准备阶段的技术管理
1.生产管理部门按照企业的生产销售情况安排生产计划,并编制批生产指令发放到生产、物料及质量等相关部门。同时,将相应的批生产记录发放至操作车间。
2.生产车间按批生产指令、生产工艺规程及岗位标准操作规程,由车间工艺技术员向各工序分别下达生产计划,各工序根据计划向仓限额领取物料,领料时需核对品名、规格、批号、生产厂家、数量、及检验合格报告单等,并填写领料记录。
3.对制剂或原料药成品质量有影响的原辅料,在货源、批号改变时,应先进行小样试制确认符合要求后填写小样试制合格报告单,经质量管理部门审核签署后方可投入生产。
4.生产操作开始前,操作人员必须对工艺卫生、设备状况等进行检查,检查内容有:
①检查生产场所卫生是否符合该区域卫生要求;
②更换批号品种及规格前要有上一批产品的“清场合格证副本”,未取得“清场合格证副本”不得进行另一个品种或同品种不同规格或不同批号产品的生产;
③设备清洁完好,有“设备清洁状态标志”;
④计量器具与称量范围相符,清洁完好,有“计量检定合格证”,并在周检有效期之内;
⑤正在检修或停用的设备应挂上“不得使用”的状态标志,检修完毕后应由设备员验收合格并清洁干净、符合要求,有设备完好状态标志才允许使用;
⑥衡器、量具使用前应进行检查、校正,对生产上用于测定、测试仪器、仪表,进行必要的调试;
⑦所用各种物料、中间产品应按质量标准核对检验报告单,中间产品有质管员签字的传递单,仔细辨别,盛装容器要桶、盖编号一致,并有明显标志;
⑧盛放物料的容器外必须具有标签,标签上应注明品名、规格、批号、重量(皮重、毛重、净重)或数量、本批容器数及加工状态、工序名称、操作日期及班次、操作人、复核人等。
二、生产过程中的技术管理
1.按GMP规定,生产过程中物料的投料、称量、计算等操作,都必须要有人复核,操作人、复核人应在操作记录上签名,车间工艺技术员、质量员均应对此关键操作进行监督。对于麻醉的药品、精神的药品、毒品、放射品及贵细药品,应按国家有关规定严格执行,使用后剩余的散装物料应及时密封,由操作人在容器上注明启封日期,剩余数量、使用者、复核者签字后,由专人办理退库手续。再次启封使用过后原辅料时,应核对记录,检查外观性状,如发现有异常情况或性质不稳定时,应再次送检,合格后方可使用。
每批生产结束后的剩余物料,操作人员应及时退库,车间不得存放未使用完的剩余物料,但中间站存放的中间产品除外。
2.生产工艺规程和标准操作规程
生产工艺规程:规定为生产一定数量成品所需起始原料和包装材料的数量,以及工艺、加工说明、注意事项、包括生产过程中控制的一个或一套文件。
标准操作规程:经批准用以指示操作的通用性文件或管理办法。
岗位操作需按生产工艺规程所规定的工艺条件和标准操作规程所规定的操作方法进行。生产工艺规程、标准操作规程一经制定,不得任意更改,如需更改时,应按照规定的程序办理修订、审批手续。
企业生产技术部门和车间工艺技术员须对生产工艺规程和标准操作规程的执行情况进行检查,即制定工艺查证制度并定期进行工艺查证,并详细记录,保证工艺规程及操作规程的准确执行。工艺查证内容由企业按各岗位操作规程的要求,检查各工艺参数执行情况、洁净区(室)温湿度以及定期检查尘埃粒子数、微生物数、质量抽查记录、工艺卫生及批生产记录。操作人员必须熟悉相关岗位的工艺控制点,质量控制点,并严格进行自控。
中药制剂车间一般生产工艺控制点有:(以片剂为例)
①提取浸膏的比重,数量,醇沉的酒精浓度等;
②中药材粉未的粒度、水份、微生物数量、粉碎物料平衡收率等;
③制粒工序的粘合剂配比、使用量,制粒温度,颗粒粒度、水份、含量均一性等;
④压片片剂的硬度、脆碎度、崩解时限或溶出度、片重差异、外观等;
⑤片剂包衣的包衣液情况、包衣片外观、崩解度、片剂增重等;
⑥内包装工序的包装数量、外观、密封性试验等;
⑦外包装工序的标签、使用说明书领用情况,外包装数量、包装质量等。
3.不同产品品种、规格的生产操作不得在同一操作意见时进行,同一品种同一规格不同批号的制剂生产及包装操作在同一操作间内进行时,应采取隔离或其它有效防止污染或混淆的措施。
生产操作人员在操作过程中动作要稳、轻、少,不做与生产无关的动作及不必要的交谈,更不能在生产操作现场嘻笑和打闹或高声唱歌。
4.生产过程中各关键工序要严格进行物料平衡的计算,符合规定的范围方可流入下一道工序。如超出范围,要按偏差处理程序进行分析调查,采取措施要经质量管理部门批准,在得出合理解释,确认无潜在的质量事故后,方可进入下一道工序。
生产过程中如发现物料异常情况,或可能存在的质量问题,操作人员不能自作主张,需向相关人员及车间领导汇报,按偏差处理程序进行处理。最终由质量管理部门决定物料的使用权。质量管理部门应遵循“三不放过”的原则,即不合格的原辅料不得投入生产,不合格的中间产品不得流入下一道工序,不合格的成品不得出厂。
生产过程、中间产品都必须在质量管理部门质管员的严格监控下,各种监控凭证要纳入批记录背面,无质管员签字发放的各种放行凭证,不得继续操作。
生产过程中如发生问题需对设备进行调节或维修时,应停机进行操作,切不可开机操作,以免造成安全事故,对人员造成伤害。
5.定置管理
为了便于养成良好的.生产习惯,减少发生差错的可能性,车间应进行定置管理。
生产操作与设备应按工艺流程的顺序合理布局,使物料的生产按同一方向顺序流动,避免物料的交叉流动,减少交叉污染的可能性,且不遗漏任何生产工序。
操作间的定置管理是指严格规定操作间的设备、各种物料及容器、操作台等的摆设位置。生产中所使用的工器具,在使用完毕后都应放回原位,不能到处丢放或放在设备里面,以免发生生产事故。
中间站等其它房间也应进行定置管理,如洁具间应规定各种清洁工具的存放位置,并严格执行制定的定置管理制度。
6.状态标志管理
与设备连接的主要固定管道包括工艺用水管道应标明管道内物料的名称及流向。管道应安装整齐、有序,或用不同的颜色进行喷涂以示区别。如物料管道
——**、蒸汽管道
——红色、饮用水管道
——蓝色、压缩空气管道
——白色等,可由各企业按自已的实际情况自定。以喷涂颜色的方向表示物料的流向。
各生产操作间也应有状态标志来说明操作间现在的生产状态。生产时应标明所生产的品种、规格、批号、生产日期、操作者等;未生产时应用清洁、待清洁等表示,清洁状态应标明清洁有效期、上批产品名称等;未使用的房间应用备用标志表示。
设备的状态有清洁、使用、备用、维修、待修等。使用时应标明所生产的品种、规格、批号、生产日期、操作人等,设备固定状态标志应标明设备的型号、设备负责人等。 物料和使用容器也应有状态标志,其内容如前面容器标签所示。
7.包装与贴签管理
对符合生产工艺规程要求,在质量管理部门和车间工艺技术员、质量员的监控下完成生产全过程,并检验合格的产品可由生产管理
部门下达批包装指令。对于一些检验周期长,需要在检验结果前包装的制剂产品,则允许先包装后按待检寄库的产品处理,检验合格后才办理入库手续。
包装所使用的标签和使用说明书,必须由车间填写领料单,派人到标签库限额领取,并由领料人及发料人签字。已打印批号的标签,发剩的和残缺标签或该批号取消时,或车间贴签工序剩余标签不得回收利用,应由经手人会同质管部门派人监督销毁,并做好记录,经手人及监督人员签字。
车间应设标签库,由专人负责标签的领用和发放,并按品种、规格分类,存放在标签库内,
上锁保管,并有记录登记,已印批号的标签,按批存放。产品包装时,由包装工序根据批包装指令派专人向车间领取并填写领用记录。
每批产品在包装完成后应及时填写包装记录,如实填写所领用的包装材料数量。如果使用数+剩余数+残损数之和与领用数不相符合时,应查明原因,并做好记录。标签不得改做他用或涂改后再使用。
8.中间站的管理
车间生产的中间产品,应存放在中间站内,不得长时间存放于操作间。中间站存放的范围包括:中间产品、待重新加工的产品、清洁的周转容器等,除上述范围以外的物品不得存放于中间站,中间站应随时保持清洁,不得有散落的物料,地上散落的物料不得回收!进入中间站的物品其外包装必须清洁,无浮尘。
中间产品在中间站应有明显的状态标志,注明品名、批号、规格、数量、并按品种、批号码放整齐,不同品种,不同批号,不同规格的产品之间应有一定的距离,物料应加盖密封保存。并以“红色牌”表示不合格,以“**牌”表示待验,以“绿色牌”表示合格,以 “白色牌”表示待重新加工,并且分堆存放。
操作人员每天及时将物料存放入中间站,并填写中间站进站记录,中间站管理员核对品名、规格、批号、重量(数量)容器数、工序名称、加工状态等,无误后检查外包装清洁情况,并由送料人及中间站管理员共同签字,填写进站日期,并将物料按规定堆放整齐。中间站管理员填写中间产品台帐及中间站物料卡,中间站进站记录应附于批生产记录上。
中间站存放的物料要求帐、卡、物一致,质量管理部门监督员及车间工艺技术员、质量员应定期对中间站的物料状况进行检查。
中间站管理员对中间产品进行请验,此时物料应挂待验状态标志,只有经检验合格后,才能挂合格的状态标志,或由质量管理部门发放中间产品合格证。
根据车间下达的工序生产指令,中间站管理员可向下一工序发放合格的中间产品,并填写中间产品出站记录,由下一工序的领料人员复核品名等到,在中间站出站记录上共同签字,同时填写中间站台帐及库卡。
中间站应上锁管理。管理人员离开时应上锁后方可离开。
9.不合格品的管理
经质量管理部门检验确认不合格的产品,由检验部门发放不合格品检验报告单,车间及时将不合格品存放于规定的不合格品存放区内,并挂上红色不合格品标志,按不合格品处理程序及时进行处理。
不合格品一般由生产管理
部门会同有关部门分析提出处理意见后报质量管理部门审核同意后,由主管领导批准,规定部门执行,限期处理,并填写处理记录。
10.模具、筛网的管理
车间设备员应对生产使用的模具建立档案,存放于相应的模具间。模具使用前后均应检查其光洁度,零配件是否齐全,有无破损,是否符合生产要求等,并填写模具使用发放记录。对破损的模具应进行维修,合格后方可使用,无法继续使用的,应办理报废手续,并根据实际情况申请采购。
筛网使用前应检查其完好程度,是否符合生产工艺的要求,每一存放的筛网都应标明其规格(目数)。生产过程中应经常检查筛网的使用情况,如发现破损应追查原因,是否对产品造成了质量影响,进行必要的处理后方可继续生产。如为质量问题应及时报告车间领导及质量管理部门进行解决。
生产过程中一般使用不易与药品产生化学反应的不锈钢或尼龙筛网。
11.生产过程中产生的特殊物料的管理
①粉头的管理
粉头是指生产过程中产生的合格的,可以回收利用的或未用完的少量物料。如胶囊充填完成后剩余的加料盘中的物料等。
生产结束后产生的粉头应及时装入洁净的容器中,注明品名、规格、批号、重量(数量)、生产日期、操作人及复核人等,送入中间站保存并做记录,报送车间工艺技术员。
车间工艺技术员根据生产安排情况,将合格的粉头投入下一批生产的同一规格品种的产品中,并要求在批生产记录中注明粉头的物料流动情况。粉头必须规定使用周期,超过规定的周期后必须进行复检,合格后才能继续使用。不合格的粉头应作为废弃物处理。
②生产中产生的废弃物的管理
生产中的废弃物是指生产过程中产生的不合格的物料及其它不能继续使用的物品,包括掉落在地上的物料、压片或胶囊充填中做装量差异(片重差异)后的片子(胶囊)、盛放物料的塑料袋等。它应按照废弃物管理规程,由生产操作人员及时将废弃物装入专门的盛放废弃物的容器中,在规定的时间,由专门的人员收集后由物料通道传出洁净区。
如下例生产过程中产生的物料如何处理?
粉碎后操作后留在粉碎机内的药物;
制粒时不小心掉在地上的颗粒;
干燥过程中取出观察颗粒外观的颗粒;
压片前试压(调机)后留下的片子;
取样检查片重差异的素片;
胶囊充填过程中怀疑有装量差异不合格的胶囊;
制粒后发现有钢丝筛网破损后的颗粒。
12.物料平衡的管理
建立并规定物料平衡检查标准,严格控制生产过程中物料收率的变化,进行严格的收率控制,使之在合理的范围内,对不正常的情况进行分析处理,这是防止差错和混淆的有效方法之一。
①物料平衡计算公式
实际值 ? 收率= ×100% ? 理论值 ? 其中:
理论值:为按照所用的原料(包装材料)理论产量(在生产中无任何损失或差错的情况下得出的最大数量)。
实际值:为生产过程中实际产出量。
如制粒工序的物料平衡计算公式
所得颗粒的总重量(kg) ? 物料平衡= ×100% ? 投入的原料辅料重量+粉头重量(kg) 口服固体制剂车间一般需计算物料平衡的工序有:
备料(粉碎、过筛);制粒、和药;制丸、压片、胶囊充填;包衣;内包装;外包装。
中药前处理工序:药材拣选;炮制加工;提取浓缩;药材干燥。
②在生产过程中如发生有跑料情况,应及时通知车间管理人员及质量管理部门,并详细记录跑料过程及数量,跑料数量也应计入物料平衡之中,加在实际值范围之内。
凡物料平衡收率不符合生产工艺规程的规定,应立即贴上待处理品的状态标志,不能递交到下一道工序,并填写偏差处理单,按偏差处理程序进行处理。
清场管理
一、定义和目的
为了防止混淆和差错事故,各生产工序在生产结束,转换品种、规格或批号前,均应进行清场。
清场的频次:每天生产结束后应进行清理,将设备表面,操作间清理干净;换品种、批号时应进行彻底的清场;连续生产规定的时间(一般三天)后,也应进行彻底清场;长时间的生产间隔后,再次开始生产之前也应进行清场。
清场必须严格按照岗位与设备等的清洁规程进行操作,车间工艺技术员、质量员及质量管理部门的质监员应对清场工作进行监督。
二、清场的内容及要求
1.地面无积灰,无结垢,门窗,室内照明灯、风管、墙面、开关箱等外壳无积尘室内不得存放与下次生产无关的物品(包括物料、文件、记录和个人杂物);
2.使用的工具、容器、应清洁,无异物、无油垢;
3.设备内外无生产遗留的药品,无油垢;
4.非专用设备、管道、容器、工具应按规定拆洗或灭菌处理;
5.凡直接接触药品的设备、管道、工具、容器应每天或每批清洗或清理。同一设备连续生产同一无菌产品时,基清洗周期可按生产工艺规程及标准操作规程执行;
6.包装工序清场时,多余的标签及使用说明书等包装材料应全部按规定处理。
三、清场记录及合格证
清场时应填写清场记录,记录内容包括工序名称、上批生产品名、规格、批号、清场日期、清场项目及检查情况、清场人及检查人签字。
清场结束由车间质量员复查合格后发放清场合格证正副本,正本纳入本批批生产记录,副本流入下一批生产记录中,清场合证应规定有效期,超过有效期的应重新进行检查。无上批清场合格证副本,车间不得进行下一批产品的生产。
;药品储存与养护的图书目录
无尘车间是指将一定空间范围内之空气中的微粒子、有害空气、细菌等之污染物排除,并将室内之温度、洁净度、室内压力、气流速度与气流分布、噪音振动及照明、静电控制在某一需求范围内,而所给予特别设计之房间。无尘车间也叫洁净厂房、洁净室(CleanRoom)、无尘室。其室内均能俱有维持原先所设定要求之洁净度、温湿度及压力等性能之特性。净化车间根据区域环境、净化程度等因素,为若干等级,常用的有国际标准和国内区域行业标准,一些知名净化工程公司,在通行标准之外,还设有自身执行的高于国际化通行标准的净化指标,净化能力和环境适应力远超国际品牌。
动线规划要点:要检讨分析人车路径、配管系统、排气管道、原料搬运和作业的流程等,尽量缩短动线,并避免交叉,以防止交叉污染。作业者、化学药品、材料等动线勿集中;无尘车间四周,宜设缓冲区;制造装置的出入,不要对作业产生大影响。
无尘车间不同级别空气洁净度的空气过滤器的选用、布置要点:对于300000级空气净化处理,可采用亚高效过滤器代替高效过滤器;空气洁净度100级、10000级及100000级的空气净化处理,应采用初、中、高效过滤器三级过滤器;中效或高效空气过滤器宜按小于或等于额定风量选用;中效空气过滤器宜集中设置在净化空气调节的正压段;高效或亚高效空气过滤器宜设置在净化空气调节系统的末端。
有些空气净化系统的空气,如经处理仍不能避免交叉污染时,则不能循环使用:固体物料的粉碎、称重、配料、混合、制料、压片、包衣、灌装等工序;用有机溶媒精制的原料药精制、干燥工序;放射品生产区;病原体操作区;工艺过程中产生大量有害物质、挥发性气体的生产工序;固体口服制剂的颗料、成品、干燥设备所使用的净化空气。
特殊药品在收货验收过程中有哪些要求
第一章 绪论
第一节 概述
一、药品储存与养护的概念
二、药品储存与养护的基本要求
第二节 药品储存与养护的目的和意义
一、药品储存与养护的目的
二、药品储存与养护的意义
第三节 药品储存与养护的基本任务
一、研究药品贮藏养护新技术、保证药品质量与数量
二、研究药品贮藏易发生的变化与治救
三、研究药品储存养护的对象与范围
第二章 药品的仓储管理
第一节 药品分类储存管理
一、药品仓库的种类
二、药品分类储存的方法
第二节 药品仓库的作业管理
一、药品仓库的设置
二、药品仓库的库区布局
第三节 药品仓库经济指标与设备管理
一、药品仓库经济指标管理
二、仓库设备管理
第三章 药品养护基础知识
第一节 简介
第二节 影响药品稳定性的因素
一、影响药品稳定性的内在因素
二、影响药品稳定性的外在因素
第三节 药品的入库验收
一、收货
二、药品验收
三、药品入库
第四节 药品的在库养护
一、药品的合理储存
二、药品的保管方法
三、药品的在库检查
第五节 药品的出库验发
一药品出库的程序
二、药品出库的原则
三、注意事项
第六节 药品的包装和运输
一、药品的包装
二、药品的运输
第七节 安全消防
一、防火措施
二、常用的消防设备
三、安全灭火
实训项目一 药品的入库验收、出库验发技术
第四章 仓库的温湿度管理
第一节 温湿度的变化规律
一、温度的变化规律
二、湿度的变化规律
第二节 温湿度变化对药品的影响
一、温度变化对药品的影响
二、湿度变化对药品的影响
第三节 仓库温湿度的控制与调节
一、温度的控制与调节
二、湿度的控制与调节
实训项目二 库房温湿度管理技术
第五章 仓库害虫的防治
第一节 仓库害虫的来源和危害
一、常见仓库害虫
二、仓库害虫的危害
第二节 仓库害虫与环境的关系
一、与温度的关系
二、与湿度的关系
三、与空气的关系
第三节 仓库害虫的防治方法
一、昆虫害虫的防治方法
二、鼠害的防治方法
第六章 药品的霉变与防治
第一节 真菌的种类和生长繁殖条件
一、真菌的形态和种类
二、真菌生长繁殖条件
第二节 真菌对药品的危害
一、真菌对中药材、中药饮片的危害
二、真菌对中成药的危害
三、真菌对其他药品的危害
第三节 药品霉变的防治方法
一、药物原料
二、药品生产环节的要求
三、药品储运流通环节的要求
第七章 药品的储存与养护
第一节 药品的分类
一、基本概念
二、药品的分类
三、药品的批准文号
第二节 药品易发生的变异现象和原因
一、内在因素使药品发生的变异现象
二、外界因素使药品发生的变异现象
第三节 药品的储存养护
一、散剂(附冲剂)的储存养护
二、片剂的储存养护
三、胶囊剂的储存养护
四、注射剂的储存养护
五、糖浆剂的储存养护
六、栓剂的储存养护
七、软膏剂、乳膏剂、糊剂和眼用半固体制剂的储存养护
八、原料药的储存养护及案例分析
第八章 中药的储存与养护
第一节 中药材的储存养护
一、中药材的质量变异现象及原因
二、中药材的储存保管
第二节 中药饮片的储存养护
一、中药饮片入库验收及质量检查
二、中药饮片的养护技术
三、中药饮片储存常发生的质量变异及防治原则
四、常见易变中药举例
第三节 中成药的储存养护
一、中成药的分类储存
二、中成药易变品种的养护
实训项目三 常见易变中药的养护技术
第九章 特殊管理药品的储存养护
第一节 特殊管理药品的概念、分类和品种
一、特殊管理药品的概念
二、特殊管理药品的分类
第二节 特殊管理药品的储存保管要求
一、品、精神药品的储存保管要求
二、毒品的储存保管要求
三、放射品的储存保管要求
实训项目四 特殊管理药品的储存技术
附录
附录1 中华人民共和国药品管理法
附录2 中华人民共和国药品管理法实施条例
附录3 药品经营质量管理规范
附录4 品和精神药品管理条例
参考文献
目标检测参考答案
药品储存与养护教学大纲
……
办理药品经营许可证需要哪些材料
1、实行双人验收、双人复核,未经验收合格的不得入库和销售。
2、验收时,除按普通药品的验收项目外,还必须对其内、外包装上印有的特殊标志进行检查,《到货验收记录单》单独存档,保存至超过药品有效期一年,不得少于三年。
3、应设专柜、双人、双锁管理。应由责任心强、工作认真负责、业务熟练的保管员担任。
4、要坚持日动碰、月盘点、账货相符率达到100%。发现问题立即逐级汇报,并及时查处。
5、必须凭合法有效出库凭证出库,没有合法有效凭证不得出库,并做好销售、出库复核记录。
6、必须单装箱,不得与一般药品混装。
7、报损销毁按《品、一类精神药品管理制度》执行。
特殊药品是指国家制定法律制度,实行比其他药品更加严格的管制的药品。
扩展资料
《药品经营质量管理规范》
第七十二条 企业应当按照规定的程序和要求对到货药品逐批进行收货、验收,防止不合格药品入库。
第七十三条 药品到货时,收货人员应当核实运输方式是否符合要求,并对照随货同行单(票)和采购记录核对药品,做到票、账、货相符。
随货同行单(票)应当包括供货单位、生产厂商、药品的通用名称、剂型、规格、批号、数量、收货单位、收货地址、发货日期等内容,并加盖供货单位药品出库专用章原印章。
第七十四条 冷藏、冷冻药品到货时,应当对其运输方式及运输过程的温度记录、运输时间等质量控制状况进行重点检查并记录。不符合温度要求的应当拒收。
第七十五条 收货人员对符合收货要求的药品,应当按品种特性要求放于相应待验区域,或者设置状态标志,通知验收。冷藏、冷冻药品应当在冷库内待验。
第七十六条 验收药品应当按照药品批号查验同批号的检验报告书。供货单位为批发企业的,检验报告书应当加盖其质量管理专用章原印章。检验报告书的传递和保存可以采用电子数据形式,但应当保证其合法性和有效性。
第七十七条 企业应当按照验收规定,对每次到货药品进行逐批抽样验收,抽取的样品应当具有代表性:
(一)同一批号的药品应当至少检查一个最小包装,但生产企业有特殊质量控制要求或者打开最小包装可能影响药品质量的,可不打开最小包装;
(二)破损、污染、渗液、封条损坏等包装异常以及零货、拼箱的,应当开箱检查至最小包装;
(三)外包装及封签完整的原料药、实施批签发管理的生物制品,可不开箱检查。
第七十八条 验收人员应当对抽样药品的外观、包装、标签、说明书以及相关的证明文件等逐一进行检查、核对;验收结束后,应当将抽取的完好样品放回原包装箱,加封并标示。
第七十九条 特殊管理的药品应当按照相关规定在专库或者专区内验收。
第八十条 验收药品应当做好验收记录,包括药品的通用名称、剂型、规格、批准文号、批号、生产日期、有效期、生产厂商、供货单位、到货数量、到货日期、验收合格数量、验收结果等内容。验收人员应当在验收记录上签署姓名和验收日期。
中药材验收记录应当包括品名、产地、供货单位、到货数量、验收合格数量等内容。中药饮片验收记录应当包括品名、规格、批号、产地、生产日期、生产厂商、供货单位、到货数量、验收合格数量等内容,实施批准文号管理的中药饮片还应当记录批准文号。
验收不合格的还应当注明不合格事项及处置措施。
第八十一条 企业应当建立库存记录,验收合格的药品应当及时入库登记;验收不合格的,不得入库,并由质量管理部门处理。
第八十二条 企业按本规范第六十九条规定进行药品直调的,可委托购货单位进行药品验收。购货单位应当严格按照本规范的要求验收药品,并建立专门的直调药品验收记录。验收当日应当将验收记录相关信息传递给直调企业。
百度百科——特殊药品
百度百科——药品经营质量管理规范
什么叫药品?
一、 开办药品批发企业按照以下程序办理《药品经营许可证》:
(一)申办人向拟办企业所在地的省、自治区、直辖市食品药品监督管理部门提出筹建申请,并提交以下材料:
1、拟办企业法定代表人、企业负责人、质量负责人学历证明原件、复印件及个人简历;
2、执业药师执业证书原件、复印件;
3、拟经营药品的范围;
4、拟设营业场所、设备、仓储设施及周边卫生环境等情况。
二、开办药品零售企业按照以下程序办理《药品经营许可证》:
(一)申办人向拟办企业所在地设区的市级食品药品监督管理部门或省、自治区、直辖市食品药品监督管理部门直接设置的县级食品药品监督管理部门提出筹建申请,并提交以下材料:
1、拟办企业法定代表人、企业负责人、质量负责人的学历、执业资格或职称证明原件、复印件及个人简历及专业技术人员资格证书、聘书;
2、拟经营药品的范围;
3、拟设营业场所、仓储设施、设备情况。
三、成都办理机构:企业所在地的食品药品监督管理局。
扩展资料具有能够配备满足当地消费者所需药品的配送能力,应备有70%以上的国家基本药物品种,有24小时需求时,有提供这种服务的能力。药品零售企业申请集中设库的:
应是两个及两个以上的药品零售企业为同一法定代表人、施行统一电子化管理的,可以申请集中设置仓库,统一质量管理标准,设置仓库总面积应与各企业合计经营规模相适应。
药品零售企业集中设库的若干企业应确立其中的一个零售企业为总店,由总店集中承租药品仓库、统一质量管理标准、建立质量保证体系和药品采购、配送体系。
百度百科-办理药品经营许可证
根据《中华人民共和国药品管理法》第一百零二条关于药品的定义:药品是指用于预防、治疗、诊断人的疾病,有目的地调节人的生理机能并规定有适应症或者功能主治、用法和用量的物质,包括中药材、中药饮片、中成药、化学原料药及其制剂、抗生素、生化药品、放射品、血清、疫苗、血液制品和诊断药品等。2013年1月,国家发展和改革委员会发出通知,决定从2013年2月1日起调整呼吸、解热镇痛和专科特殊用药等药品的最高零售限价,共涉及20类药品,400多个品种、700多个代表剂型规格,平均降价幅度为15%,其中高价药品平均降幅达到20%。
中文名
药品
外文名
medicien
根据
《中华人民共和国药品管理法》
作用
预防、治疗、诊断人的疾病
包括
中药材、中药饮片、中成药
品种
400多个品种
1特性介绍编辑
从使用对象上说:它是以人为使用对象,预防、治疗、诊断人的疾病。有目的地调节人的生理机能,有规定
的适用症、用法和用量要求;从使用方法上说:除外观,患者无法辨认其内在质量,许多药品需要在医生的指导下使用,而不由患者选择决定。同时,药品的使用方法、数量、时间等多种因素在很大程度上决定其使用效果,误用不仅不能“治病”,还可能“致病”,甚至危及生命安全。因此,药品是一种特殊的商品。
1.种类复杂性:具体品种,全世界大约有20000余种,我国中药制剂约5000多种,西药制剂约4000多种,由此可见,药品的种类复杂、品种繁多。
2.药品的医用专属性:药品不是一种独立的商品,它与医学紧密结合,相辅相成。患者只有通过医生的检查诊断,并在医生的指导下合理用药,才能达到防止疾病、保护健康的目的。
3.药品质量的严格性:药品直接关系到人们的身体健康甚至生命存亡,因此,其质量不得有半点马虎。我们必须确保药品的安全、有效、均一、稳定。
另外,药品的质量还有显著的特点:它不像其他商品一样,有质量等级之分:优等品、一等品、二等品、合格品等等,都可以销售,而药品只有符合规定与不符合规定之分,只有符合规定的产品才能允许销售,否则不得销售。
2管理规范编辑
药品质量符合规定不仅是产品质量符合注册质量标准,还应使其全过程符合《药品生产质量管理规范》(简称GMP)。
《药品生产质量管理规范》(Good Manufacture Practice,GMP)是药品生产和质量管理的基本准则,适用于药品制剂生产的全过程和原料药生产中影响成品质量的关键工序。大力推行药品GMP,是为了最大限度地避免药品生产过程中的污染和交叉污染,降低各种差错的发生,是提高药品质量的重要措施。
3降价编辑
2013年1月初,国家发展和改革委员会发出通知,决定从2013年2月1日起调整呼吸、解热镇痛和专科特殊用药等药品的最高零售限价,共涉及20类药品,400多个品种、700多个代表剂型规格,平均降价幅度为15%,其中高价药品平均降幅达到20%。[1]
最早医保品种平均降价四成
据国家发改委价格司有关负责人介绍,对纳入政府定价范围内的药品(主要是医保目录内药品),发展改革委依据药品成本和市场价格变化情况等因素,实行价格动态调整机制,一般2—3年调整一次。国家发改委从2001年起,已先后出台了三轮药品价格调整方案,涉及近2000种药品。最早进入医保目录的品种,累计降价幅度平均已达40%,高的达到80%;最新进入医保目录的品种,降价刚刚开始,平均15%左右。[1]
2001年到2003年的首轮调整,对政府管理价格药品进行了首次全面调整。[1]
2006年至2007年的第二轮调整结合医保目录品种,再次对政府管理价格药品进行全面调整。[1]
2011年至2012年,发改委对政府管理价格的化学药品进行了全面调整。[1]
2011年至今已分四批调整的抗生素、循环、神经、激素、消化、抗肿瘤、免疫和血液等8类药品,属于同一轮次调价品种,大部分属于临床常用药品。至此,发改委对化学药品的价格调整基本完成,从2013年起,将启动中成药价格的调整工作。[1]
对临床短缺低价药适当提价
据国家发改委有关部门对此前药品价格调整的跟踪和调查,药品调价对常年用药患者的减负作用明显。最新一轮药品降价可每年减少病人负担600多亿元。这一轮调价高价药品平均降幅达到20%。如治疗阿尔茨海默症(老年痴呆)的卡巴拉汀胶囊1.5毫克×28片(诺华生产,商品名“艾斯能”),降价前日费用32.6元,降价后日费用19.8元,降幅39%。[1]
同时,药品调价对企业生产结构调整也起到了积极作用。国家发改委有关负责人表示,对媒体反映的部分药品“降价”的问题,调查发现,除短期下架情况外,确有极少数药品因企业经营不善、产品市场使用率低等原因退出市场,但没有发现仅仅因为降低价格而消失的情况。此次国家在降低高价药品价格、减轻群众用药负担的同时,也注重加强了对低价药品的价格扶持。特别是对临床短缺的低价药品,国家发改委在开展成本价格调查、专家评审和广泛听取有关方面意见的基础上适当提高了价格,以鼓励低价药的生产供应,满足临床需要。[1]
4使命编辑
制药人的使命:保障药品安全、有效、均一、稳定。
第一,社会公共性。人类的生物秉赋一直在促使人类尽可能的增进健康、延长生命以保证人类的繁衍。药品因其特殊功效而倍受重视。在现代社会,享有健康的权利和生命的权利已经成为受法律保护的基本人权。因此,药品关系到整个人类社会的繁衍和发展。药品的社会公共性是建立全民医疗保健和医疗保险制度的依据。
第二,作用的两重性。药品可以防病治病,康复保健,然而“是药三分毒”,任何药品又有不同程度的毒副作用。所以管理有方、用之得当,药品就能治病救人,保护健康。反之,则会堕落成可怖的毒药,危害人体健康和生命安全。
第三,质量的单一性。药品的物理、化学、生物药剂学、安全性、有效性、稳定性、均一性等质量指标必须符合国家规定的标准。只有符合国家标准的药品,才能保证疗效。低于或高于规定的质量标准都可能降低甚至失去药品的疗效或者加剧药品的毒、副作用。因此,进入流通渠道的药品,只允许有合格品,绝对不允许有次品或等外品。
第四,鉴定的专业性。药品质量的优劣、真伪,一般消费者难以识别。必须有专业的技术人员和专门机构,依据法定的标准,运用科学的方法和合乎要求的仪器设备,才能做出鉴定。
第五,适用的局限性。由于缺乏治病防病所需的专业医学和药学知识,人们多数情况下只能在执业医师和执业药师的指导下,甚至还要在医护人员的监护下,才能合理用药,达到防病治病、保护健康的目的。若滥用药物则容易造成中毒或产生药源性疾病。另外,人们生病时有时更需要一点药物的配合。
5分类编辑
药品按照用途分类包括感冒药、退烧药、胃药、泻药、催眠药等各种有利于健康的药品,按照性质分类包括中药材、中药饮片、中成药、中西成药,化学原料药及其制剂、抗生素、生化药品、放射品、血清、疫苗、血液制品和诊断药品等。
6出口前景编辑
2010年中国将超过印度成为最受欢迎的国际药品采购地。
中国的原料药及药物有效成分出口额预计将从2007年的56.3亿美元增长到2010年的99亿美元,而印度将从2007年的17亿美元增长到2010年的27.6亿美元。
中国出口的这些产品主要包括抗生素、维生素、氨基酸和有机酸,主要市场包括欧盟、美国、印度和日本。在成品药出口方面,印度将继续领先,出口额预计从2007年的48亿美元增长到2010年的64亿美元;中国则从2007年的7亿美元增长到2010年的18.8亿美元。
在国际采购市场上,综合成本、市场机会和风险因素等指标,在药品外采受欢迎程度方面中国列第一,印度第二,韩国列第三。尽管印度药品出口额超过中国,但中国在原料药和药物有效成分出口方面已经取得了领先地位。
7发展现状编辑
“国内新药研发热情高涨,人员众多,需求紧迫,市场广阔加上政府的重视,可以说是机遇频生,但现状并不乐观。”在第四届中国国际生物医药发展峰会上,这样的观点很具代表性。
1.新药难找,仿药难仿
“现有的研发模式和流程越来越难以发现新药了。在现有生命科学技术的基础上,经过一轮又一轮的筛选,几乎所有已知的生物化学分子反应和生化酶反应都被制药工业开发了。”美国FDA资深审查官和临床药理学家John Duan 表示。
新药产出率降低,研发成本不断上升,临床时间过长,上市过程太慢……这些关于药物创新的老生常谈依然存在,并且由于本身的基础薄弱,积累匮乏,国内生物药发展的可持续性困难重重。
生物医药产业一直以高于总体医药工业的速度增长,但国内生物药技术依然与发达国家有相当大的差距,生物医药企业的规模相比化学药企业也小了许多。而国内化学药一直在走的“me to(仿制)-me better(更好的仿制)-me new(创新)”路线,这对于生物药来说也并不容易。原因在于,生物仿制药的生物等效性难以确定。
实际上,化学药和生物药之间的生产过程差异很大。化学药属于简单的小分子化合物,通过控制化学配方,可以轻易生产出结构相似的产品,同时,通过实验室试验就可以确认仿制药是否与原始专利产品具有相同的功效。但生物药的情形完全不同,一个微小基团的差异就会导致大相径庭的功效。因此,无论在美国或是中国,生物仿制药想要获得监管部门的审批都是非常困难的。而如果以大规模临床试验证明其具有生物等效性,则费用和时间花费是相当可观的。
上海生物芯片公司高级副总裁金刚分析说,生物制药本身已经是高投入、高风险的行业。仿制药没有专利保护,花了大力气去做临床试验,结果市场没有保护,很容易被其他竞争者复制,利润迅速降低。因此在美国,没有专利的药是没有风投愿意接受的。即使有完整的专利保护,专利技术与可以上市的产品之间仍有很长的路,甚至许多专利本身并不具备上市的可能性或者目标市场过小,没有上市的意义。也就是说,开发的产品不仅要具有生物成药性,还要有完整的专利保护。
2.资金与技术不完全对接
回国一年多,免疫学、医学博士张磊发现一些让他很困惑的现象:国内做研发的机构及一些生物公司穷得叮当响,研发及成果转化很困难;与此同时,投资公司却因投资周期过长、看不到明确前景、找不到下家等原因不敢轻易注资。
实际上,由于医药行业的高成长性,有不少资金围着医药打转,但据了解,国内生物医药所吸引的资金仅占整个医药融资5%左右的份额。另外,一般的财务投资多是希望短时间内就能见到效益,而一个药品要上市则是一项需要长时间才能见到成果的,即使上了市,后续的风险依然存在。相对而言,战略投资更注重长期效益,可以花数年进行融资并帮助企业做战略规划、管理优化等。
百奥维达中国基金合伙人李毅表示,医药行业的投资机会还是很多的,作为专业投资公司,他们可能会选择一些拥有突破性平台技术或巨大市场的早期企业,即使这些企业非常小或需要比较长的投资回报时间,只要企业具备高效合作的管理团队、自主的产品、显著的竞争优势、明确的市场机会和可持续的商业模式等特点,投资公司是愿意接受的。
能够达到上述标准的国内企业并不太多。另外,由于上下游依存链没有建立,国内很多企业只是单纯以研发为主导,再进行项目的转让,缺乏长远战略定位和市场考量。
“中国其实不缺乏生物研发人才,但没有形成以企业为主体的创新体系,也没有形成风投市场,中国生物医药产业的潜力大,但模式不清。”一位业内人士如是评价。
3.寻找生物药火种
中美冠科生物技术(北京)有限公司总裁张发明认为,从前我们的研发模式是拿着个放大镜在一堆柴草里寻找一根可以治病的针,我们需要放一把火,把不需要的柴草烧掉,那么留下的就是针。在新药研发中,生物标记物就是这根可以烧稻草的火柴。
所谓生物标记物,就是通过基因组学和肿瘤组学知识进行研究,找到那些可供客观测定和评价的一个普通生理或病理或治疗过程中的某种特征性的生化指标,通过它可以获知机体当前所处的生物学过程中的进程。
实际上,这是一种研发思路的转变。John Duan表示,常规的新药研究方法是先进行基础研究,再从大量的化合物样品库中发现有药理活性的化合物,然后进行化学结构优化和设计、临床前研究、临床试验等步骤。通常从1万个化合物中筛选出有药理活性的化合物不到1个,能够到达临床试验的更少。可以转变为从疾病研究开始,研究疾病的本身原理,弄清楚最具有影响力的区域,针对其进行具有靶向性的研究和筛选。“更好的靶向鉴定能力不仅可以提高先导化合物的筛选效率,也可以在早期临床研究阶段对药物有效性进行更精确的判断。
“在选择项目时要有眼光,要清楚研发产品是否拥有足够规模的市场,这类药物淘汰的周期是多长时间,可别学会了屠龙术,结果根本找不到龙。”与会人士形容说。
有机构预测,至2010年,中国将成为世界第七大医药市场,中国国民在健康领域的需求具有巨大的增长力。生物医药由于具有特异性强、准确率高等特点,能进行研究的领域还很多。只是中国的生物医药仍处于产业初级阶段,需要很长的时间培育。
8假药介绍编辑
药品(5张)
假药(Bogus Drug)按照《中华人民共和国药品管理法》第四十八条:禁止生产(包括配制,下同)、销售假药。
有下列情形之一的,为假药:
(一)药品所含成份与国家药品标准规定的成份不符的;
(二)以非药品冒充药品或者以他种药品冒充此种药品的。
有下列情形之一的药品,按假药论处:
(一)药品监督管理部门规定禁止使用的;
(二)依照本法必须批准而未经批准生产、进口,或者依照本法必须检验而未经检验即销售的;
(三)变质的;
(四)被污染的;
(五)使用依照本法必须取得批准文号而未取得批准文号的原料药生产的;
(六)所标明的适应症或者功能主治超出规定范围的。
补充
明星代言药品明知是假药的将被追究刑责副院长熊选国在新闻办公室举行的新闻发布会上指出,明星代言药品如果明知是假药的将被追究刑责。
熊选国提到明星代言行为时说,从司法解释角度来看,首先还是提供广告宣传这样一个行为的定位问题。根据《刑法》的规定,生产、销售假药、劣药犯罪,是故意犯罪,构成共犯是以知道或者应当知道他人生产、销售假药、劣药为前提的。所以对于明星的代言行为,如果他是明知他人生产、销售假药、劣药,符合《刑法》规定,作为共犯处理是可以的,但是这个前提很重要。
据了解,2009年5月13日、最高人民检察院会签了《关于办理生产、销售假药、劣药刑事案件具体应用法律若干问题的解释》,将于2009年5月27日起施行。《解释》明确了办理生产、销售假药、劣药刑事案件法律适用中的一些疑难问题。
避免假药
第一步:选择正规的药房网
消费者要辨别信息的真假,首先要到合法的、正规的药房网购买。统计显示,截至2010年11月15日,全国共有2588家提供药品服务信息的合法网站,其中涉及药品交易的网站有54家。这54家提供药品交易服务的网站中,具有合法资质可向个人销售药品的网站只有33家,选择正规的药房网,是避免买到假药的重要一步。
第二步:如何辨别药品真假
药品外观鉴别技巧所述的外观,具有两层含义其一是指药品包装所涉及的外观,包括包装箱,包装盒,药瓶,标签,说明书等项,其二是指药品本身的外观形状。
通过外观检查鉴别方法判断检品是否为假劣药品时,应注意以下几个问题:
1.鉴别最基本的技术依据是比较法
这是建立在真品与假品对照比较基础上的一种方法,因而,药品检查人员应了解,熟悉各种正规生产厂家的产品外观,这就要求我们在平时的检查工作中积累经验,不断提高鉴别水平。
2.查药品的来源渠道
在检查药品的过程中,要审查各种药品的来源单据,并审慎辨认发货票据的真伪,加强对相关情况的检查,假劣药品的生产,销售渠道和正规产品显然是有区别的。
3.查药品的价格
假劣药品的销售价格一般明显低于正品的价格,有的甚至低于产品的成本价,在药品监督检查中,若发现某一药品的价格明显低于或背离成本价格则应引起注意,及时进行抽验。
4.药品大体也有规律
畅销品种,紧俏品种,知名品牌,贵重药品多为制假对象,而假中掺真的现象亦有发生,手段在不断改变,药品检查人员应针对实际情况灵活应对。
5.药品外观鉴别的现场性很强
所以其方法和基本环境也受一定的限制,在条件允许的情况下,应尽量用快速检验鉴别法开展实验,得出进一步的结论,如薄层色谱和化学反应鉴别法。
辨别真假
简单的鉴别方法:
一.就是看包装上的批准文号。
1. 药品在包装上一定能够看到批准文号:“国药准字H(或Z.S.J.B.F)+8位数字”,它的意思是国家药监局批准生产、上市销售的药品,H字母代表化学药品、Z中成药、S生物制品、 J进口药品国内分包装、B具有辅助治疗作用的药品、 F药用辅料。
2.如果包装上没有“国药准字”肯定不是药品,如果有“国药准字”登陆国家药监局数据查询,输入药品名称或“国药准字”后面的字母和8数字,查到的是真药,查不到的就是假药。
3.如果批准文号是:X药制字H(Z)+ 4位年号+4位流水号,这样的批准文号是医院制剂,只可在本医院使用,不可在其他医院和药店销售。
4.如果在药品的包装上未标明或者更改有效期的,不注明或者更改生产批号的,超过有效期的都是劣药。
5.保健食品和食品的鉴别方法。
(1).保健品在包装上一定能够看到国家药监局的批准文号:国食健字G(J)+8为数字,字母G指国产J指进口。或卫生部的批准文号:卫食健字(卫食健进字)+8位数字。 并且规定在包装或标签上方必须标有保健品的特殊标识:“蓝帽子”,一个类似蓝帽子的图案,下面有保健食品四个字,保健食品四个字下面就是批准文号。 没有蓝帽子和保健食品批准文号的就是假的保健品。
(2).食品在包装上标示有“食品生产许可证号”都是以QS开头后面加12位流水号。有“卫生许可证号”以各省的简称开头后面是流水号,如豫卫食证字、粤卫食证字、沪卫食证字等,它的标识是一个长方形的白底里有个变形蓝Q字加白色的S。叫QS标识,QS下面有质量安全四个字。
6. 辨别药品时就要看有没有批准文号:“国药准字”,有国药准字,就登陆国家药监局数据库,查不到就是假药。买保健品时就要看:有没有蓝帽子和国家的批准文号,也可以登陆国家药监局数据库,查不到的就是假保健品。买食品时要看有没有QS标识和食品生产许可证号。
复杂的鉴别方法:专业的机构(药品检验所)通过化学、物理等检测方法才能判断药品的真假。
9保管原则编辑
1.性能相互影响,容易串味,名称容易搞错的品种也应分开存放。
2、品、精神药品的毒品应专库或专柜存放,指定专人保管。
3、危险品应严格执行公安部颁发的“化学危险品储存管理暂行办法”、“爆炸物品管理规则”和“仓库防火安全管理规则”等规定,按其危险性质,分类存放于有专门设施的专用仓库。
4、有效药品按效期远近,按批号,依次专码堆放。并按“中国医药公司医药商品调拔责任制”规定的期限,定期报告业务部门及时销售。
5、长期储存的怕压商品定期翻码整垛,货垛间应采取必要的隔垫措施。
6、退货商品应单独存放和标记。要查清原因,及时处理。因质量问题而退货的药品征得卫生行政部门同意返工后,必须重新检验合格后才能返回库存。退货要作记录(包括退货单位、日期、品名、规格、数量、退货理由、检查结果、处理日期及处理情况等内容)并保存两年。
7、搬运和堆垛应严格遵守药品外包装标记的要求,安全操作,防止野蛮装卸。
(五)就厂直拔药品要注意与库存同品种及时轮换,国家储备药品和外库储存药品及时轮换更新。
(六)要贯彻“先进先出”,“近期先出”和“易变先出”,按批号出库的原则。药品出库时登记生产批号或年、月、日,有效期限及入库年、月、日。要把好药品出库验发关,变质和过期药品严禁发货。
(七)各医药仓库,凡库容面积在3000m以上的,均应建立养护专业组织,小于3000m的仓库应设立专职养护人员。
(八)药品养护工作的任务
1、指导保管人员对药品进行科学储存。
2、检查库存药品的储存条件是否符合要求,配合保管人员进行他间温湿度管理,及时调整库存条件。
3、对库存药品定期进行循环质量抽查,循环抽查的周期一般为一个季度,易变质药品要缩短抽查周期。
4、对抽查中发现的问题,提出处理意见和改进养护措施。配合保管人员对有问题品种进行必要的整理。
5、根据季节气候的变化,拟定药品检查计划和养护工作计划,列出重点养护品种,并予以实施。
6、建立药品养护档案。
7、对重点品种开展留样观察,考察变化的原因及规律,为指导合理库存,提高保管水平和促进药厂提高产品质量提供资料。
8、开展养护科研工作,逐步使仓库保管养护科学化、现代化。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。