原料药测定方法-原料药对照品标定方法
国药准字H代表化学药品,国药准字Z代表中成药,区分是根据药品品种的首字第一个拼音字母,具体划分类型介绍:
一、H代表化学药品 ,包括以下类型:
1、通过合成或者半合成的方法制得的原料药及其制剂。
2、天然物质中提取或者通过发酵提取的新的有效单体及其制剂。
3、用拆分或者合成等方法制得的已知药物中的光学异构体及其制剂。
4、由已上市销售的多组份药物制备为较少组份的药物。
5、新的复方制剂。
二、Z代表中成药 ,包括以下类型:
1、两个或两个以上功效相似的中成药同用,以增强药效的用药方法。
2、功效不同的 中成药配伍同用,一药为主,一药为辅,辅药能够提高主要功效。
3、其中一种药物能够明显抑制或消除另一种中成药的偏性或副作用。
4、也有些中成药的配伍是因为部分疾病的治疗必须采用不同的治疗方法。
三、字母包括H、Z、S、 B、T、F、J,分别代表药品不同类别:
1、H代表化学药品,
2、Z代表中成药,
3、S代表生物制品,
4、B代表保健药品,
5、T代表体外化学诊断试剂,
6、F代表药用辅料,
7、J代表进口分包装药品。
扩展资料
法律规定:
《中华人民共和国药品管理法》
第三十一条 生产新药或者已有国家标准的药品的,须经药品监督管理部门批准,并发给药品批准文号;但是,生产没有实施批准文号管理的中药材和中药饮片除外。实施批准文号管理的中药材、中药饮片品种目录由药品监督管理部门会同中医药管理部门制定。 药品生产企业在取得药品批准文号后,方可生产该药品。
第三十二条 药品必须符合国家药品标准。中药饮片依照本法第十条第二款的规定执行。 药品监督管理部门颁布的《中华人民共和国药典》和药品标准为国家药品标准。药品监督管理部门组织药典委员会,负责国家药品标准的制定和修订。 药品监督管理部门的药品检验机构负责标定国家药品标准品、对照品。
百度百科-中成药(中草药制品)
百度百科-化学药品
百度百科-批准文号
百度百科-国药准字
在中国境内上市的药品,应当取得( )
方法名称: 芬布芬原料药—芬布芬的测定—中和滴定法
应用范围: 本方法采用滴定法测定芬布芬原料药中芬布芬的含量。
本方法适用于芬布芬原料药。
方法原理: 供试品加中性乙醇溶解后,加酚酞指示液,用氢氧化钠滴定液滴定,并将滴定的结果用空白试验校正,根据滴定液使用量,计算芬布芬的含量。
试剂: 1. 中性乙醇
2. 氢氧化钠滴定液(0.1mol/L)
3. 酚酞指示液
4. 基准邻苯二甲酸氢钾
仪器设备:
试样制备: 1. 氢氧化钠滴定液(0.1mol/L)
配制:取氢氧化钠适量,加水振摇使溶解成饱和溶液,冷却后,置聚乙烯塑料瓶中,静置数日,澄清后备用。取澄清的氢氧化钠饱和溶液5.6mL,加新沸过的冷水使成1000mL,摇匀。
标定:取在105℃干燥至恒重的基准邻苯二甲酸氢钾约0.6g,精密称定,加新沸过的冷水50mL,振摇,使其尽量溶解,加酚酞指示液2滴,用本液滴定,在接近终点时,应使邻苯二甲酸氢钾完全溶解,滴定至溶液显粉红色。每1mL氢氧化钠滴定液(0.1mol/L)相当于20.42mg的邻苯二甲酸氢钾。根据本液的消耗量与邻苯二甲酸氢钾的取用量,算出本液的浓度。
贮藏:置聚乙烯塑料瓶中,密封保存;塞中有2孔,孔内各插入玻璃管1支,1管与钠石灰管相连,1管供吸出本液使用。
2. 酚酞指示液
取酚酞1g,加乙醇100mL使溶解。
操作步骤: 精密称取供试品约0.4g,加中性乙醇50mL,置热水中使溶解,冷却至室温,加酚酞指示液2滴,用氢氧化钠滴定液(0.1mol/L)滴定。每1mL氢氧化钠滴定液(0.1mol/L)相当于25.43mg的C16H14O3。
注:“精密称取”系指称取重量应准确至所称取重量的千分之一。“精密量取”系指量取体积的准确度应符合国家标准中对该体积移液管的精度要求。
参考文献: 中华人民共和国药典,国家药典委员会编,化学工业出版社,2005年版,二部,p.225。 (1)少数患者服后有胃痛、恶心、头晕、皮疹、白细胞数微降等。个别患者出现氨基转移酶微升现象,但停药1周即自行恢复正常。
(2)14岁以下儿童不宜服用。
(3)胃与十二指肠溃疡者及孕妇、哺乳期妇女慎用。 同其他非甾体抗炎药有交叉过敏反应。
孕妇及哺乳期妇女用药,禁用。
儿童用药,禁用。
老年患者用药,老年患者因肾功能下降,应注意肾脏毒性。 芬布芬别名联苯丁酮酸,苯酮酸,Apam,Bifene,Bufemid,Cinapal,Cybufen,Lederfen,Napanol。
适应证类风湿性关节炎、骨关节炎、痛风、强直性脊柱炎、头痛、牙痛、咽喉肿痛、外伤及手术后疼痛等。 2010版中国药典修订增订内容
芬布芬
Fenbufen
Fenbufen
书页号:2005年版二部-225
[修订]
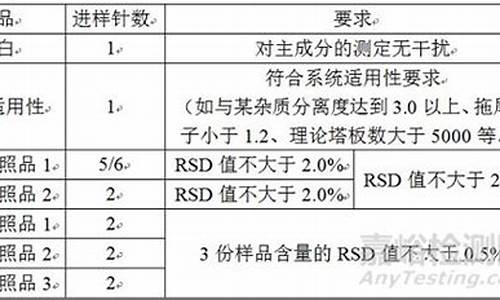
检查 有关物质 取本品约50mg,精密称定,置25m量瓶中,加N,N-二甲基甲酰胺10ml,振摇使溶解,再加1.8%冰醋酸溶液-乙腈(68︰32)稀释至刻度,摇匀,作为供试品溶液;精密量取1ml,置100ml量瓶中,加1.8%冰醋酸溶液-乙腈(68︰32)稀释至刻度,摇匀,作为对照溶液。另取芬布芬、酮洛芬对照品适量,用1.8%冰醋酸溶液-乙腈(68︰32)溶解并稀释制成每1ml中约含芬布芬0.02mg、酮洛芬0.05mg的溶液,作为系统适用性溶液。照高效液相色谱法(附录 V D)测定,用十八烷基硅烷键合硅胶为填充剂;流动相A为1.8%冰醋酸溶液;流动相B为乙睛;流速为1.5ml/min;检测波长为283nm;柱温为30℃;按下表进行梯度洗脱。取系统适用性溶液20μl注入液相色谱仪,酮洛芬峰与芬布芬峰之间的分离度应大于5.0。取对照溶液20μl注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高约为满量程的10%~20%。再精密量取供试品溶液与对照溶液各20μl,分别注入液相色谱仪,记录色谱图,供试品色谱图中如有杂质峰,单个杂质峰面积不得大于对照溶液中主峰面积,各杂质峰面积的和不得大于对照溶液主峰面积的两倍。 时间(分钟) 流动相A(%) 流动相B(%) 0 68 32 25 68 32 30 50 50 55 50 50 60 68 32 65 68 32
开办药品生产企业必须具备哪些条件?
在中国境内上市的药品,应当经药品监督管理部门批准,取得药品注册证书;但是,未实施审批管理的中药材和中药饮片除外。
根据中华人民共和国药品管理法 第二章 药品研制和注册
第二十四条 在中国境内上市的药品,应当经药品监督管理部门批准,取得药品注册证书;但是,未实施审批管理的中药材和中药饮片除外。实施审批管理的中药材、中药饮片品种目录由药品监督管理部门会同中医药主管部门制定。
申请药品注册,应当提供真实、充分、可靠的数据、资料和样品,证明药品的安全性、有效性和质量可控性。
第二十五条 对申请注册的药品,药品监督管理部门应当组织药学、医学和其他技术人员进行审评,对药品的安全性、有效性和质量可控性以及申请人的质量管理、风险防控和责任赔偿等能力进行审查;符合条件的,颁发药品注册证书。
药品监督管理部门在审批药品时,对化学原料药一并审评审批,对相关辅料、直接接触药品的包装材料和容器一并审评,对药品的质量标准、生产工艺、标签和说明书一并核准。
本法所称辅料,是指生产药品和调配处方时所用的赋形剂和附加剂。
第二十六条 对治疗严重危及生命且尚无有效治疗手段的疾病以及公共卫生方面急需的药品,药物临床试验已有数据显示疗效并能预测其临床价值的,可以附条件批准,并在药品注册证书中载明相关事项。
第二十七条 药品监督管理部门应当完善药品审评审批工作制度,加强能力建设,建立健全沟通交流、专家咨询等机制,优化审评审批流程,提高审评审批效率。
批准上市药品的审评结论和依据应当依法公开,接受社会监督。对审评审批中知悉的商业秘密应当保密。
第二十八条 药品应当符合国家药品标准。经药品监督管理部门核准的药品质量标准高于国家药品标准的,按照经核准的药品质量标准执行;没有国家药品标准的,应当符合经核准的药品质量标准。
药品监督管理部门颁布的《中华人民共和国药典》和药品标准为国家药品标准。
药品监督管理部门会同卫生健康主管部门组织药典委员会,负责国家药品标准的制定和修订。
药品监督管理部门设置或者指定的药品检验机构负责标定国家药品标准品、对照品。
第二十九条 列入国家药品标准的药品名称为药品通用名称。已经作为药品通用名称的,该名称不得作为药品商标使用。
开办药品生产企业必须具备哪些条件
根据《中华人民共和国药品管理法》第八条:
开办药品生产企业,必须具备以下条件:
(一)具有依法经过资格认定的药学技术人员、工程技术人员及相应的技术工人;
(二)具有与其药品生产相适应的厂房、设施和卫生环境;
(三)具有能对所生产药品进行质量管理和质量检验的机构、人员以及必要的仪器设备;
(四)具有保证药品质量的规章制度。
第十五条开办药品经营企业必须具备以下条件:
(一)具有依法经过资格认定的药学技术人员;
(二)具有与所经营药品相适应的营业场所、设备、仓储设施、卫生环境;
(三)具有与所经营药品相适应的质量管理机构或者人员;
(四)具有保证所经营药品质量的规章制度。
根据《药品经营许可证管理办法》规定
第四条按照《药品管理法》第14条规定,开办药品批发企业,应符合省、自治区、直辖市药品批发企业合理布局的要求,并符合以下设置标准:
(一)具有保证所经营药品质量的规章制度;
(二)企业、企业法定代表人或企业负责人、质量管理负责人无《药品管理法》第75条、第82条规定的情形;
(三)具有与经营规模相适应的一定数量的执业药师。质量管理负责人具有大学以上学历,且必须是执业药师;
(四)具有能够保证药品储存质量要求的、与其经营品种和规模相适应的常温库、阴凉库、冷库。仓库中具有适合药品储存的专用货架和实现药品入库、传送、分检、上架、出库现代物流系统的装置和设备;
(五)具有独立的计算机管理信息系统,能覆盖企业内药品的购进、储存、销售以及经营和质量控制的全过程;能全面记录企业经营管理及实施《药品经营质量管理规范》方面的信息;符合《药品经营质量管理规范》对药品经营各环节的要求,并具有可以实现接受当地食品药品监督管理部门监管的条件;
(六)具有符合《药品经营质量管理规范》对药品营业场所及辅助、办公用房以及仓库管理、仓库内药品质量安全保障和进出库、在库储存与养护方面的条件。
国家对经营品、精神药品、医疗用毒品、预防性生物制品另有规定的,从其规定。
扩展资料
第三十一条生产新药或者已有国家标准的药品的,须经药品监督管理部门批准,并发给药品批准文号;但是,生产没有实施批准文号管理的中药材和中药饮片除外。实施批准文号管理的中药材、中药饮片品种目录由药品监督管理部门会同中医药管理部门制定。
药品生产企业在取得药品批准文号后,方可生产该药品。
第三十二条药品必须符合国家药品标准。中药饮片依照本法第十条第二款的规定执行。
药品监督管理部门颁布的《中华人民共和国药典》和药品标准为国家药品标准。
药品监督管理部门组织药典委员会,负责国家药品标准的制定和修订。
药品监督管理部门的药品检验机构负责标定国家药品标准品、对照品。
第四十八条禁止生产(包括配制,下同)、销售假药。
有下列情形之一的,为假药:
(一)药品所含成份与国家药品标准规定的成份不符的;
(二)以非药品冒充药品或者以他种药品冒充此种药品的。
有下列情形之一的药品,按假药论处:
(一)药品监督管理部门规定禁止使用的;
(二)依照本法必须批准而未经批准生产、进口,或者依照本法必须检验而未经检验即销售的;?[3]?
(三)变质的;
(四)被污染的;
(五)使用依照本法必须取得批准文号而未取得批准文号的原料药生产的;
(六)所标明的适应症或者功能主治超出规定范围的。
第四十九条禁止生产、销售劣药。
药品成份的含量不符合国家药品标准的,为劣药。
有下列情形之一的药品,按劣药论处:
(一)未标明有效期或者更改有效期的;
(二)不注明或者更改生产批号的;
(三)超过有效期的;
(四)直接接触药品的包装材料和容器未经批准的;
(五)擅自添加着色剂、防腐剂、香料、矫味剂及辅料的;
(六)其他不符合药品标准规定的。
第五十条列入国家药品标准的药品名称为药品通用名称。已经作为药品通用名称的,该名称不得作为药品商标使用。
第五十一条药品生产企业、药品经营企业和医疗机构直接接触药品的工作人员,必须每年进行健康检查。患有传染病或者其他可能污染药品的疾病的,不得从事直接接触药品的工作。
第五十二条直接接触药品的包装材料和容器,必须符合药用要求,符合保障人体健康、安全的标准,并由药品监督管理部门在审批药品时一并审批。
药品生产企业不得使用未经批准的直接接触药品的包装材料和容器。
对不合格的直接接触药品的包装材料和容器,由药品监督管理部门责令停止使用。
第五十三条药品包装必须适合药品质量的要求,方便储存、运输和医疗使用。
发运中药材必须有包装。在每件包装上,必须注明品名、产地、日期、调出单位,并附有质量合格的标志。
第五十四条药品包装必须按照规定印有或者贴有标签并附有说明书。
标签或者说明书上必须注明药品的通用名称、成份、规格、生产企业、批准文号、产品批号、生产日期、有效期、适应症或者功能主治、用法、用量、禁忌、不良反应和注意事项。
品、精神药品、医疗用毒品、放射品、外用药品和非处方药的标签,必须印有规定的标志。
百度百科-《中华人民共和国药品管理法》
百度百科-《药品经营许可证管理办法》
《中华人民共和国药品管理法》第五章药品管理法
《药品生产质量管理规范》
第七条 开办药品生产企业,须经企业所在地省、自治区、直辖市人民政府药品监督管理部门批准并发给《药品生产许可证》。无《药品生产许可证》的,不得生产药品。
《药品生产许可证》应当标明有效期和生产范围,到期重新审查发证。
第八条 开办药品生产企业,必须具备以下条件:
1、具有依法经过资格认定的药学技术人员、工程技术人员及相应的技术工人;
2、具有与其药品生产相适应的厂房、设施和卫生环境;
3、具有能对所生产药品进行质量管理和质量检验的机构、人员以及必要的仪器设备;
4、具有保证药品质量的规章制度。
第九条 药品生产企业必须按照药品监督管理部门依据本法制定的《药品生产质量管理规范》组织生产。药品监督管理部门按照规定对药品生产企业是否符合《药品生产质量管理规范》的要求进行认证;对认证合格的,发给认证证书。
第十条 除中药饮片的炮制外,药品必须按照国家药品标准和药品监督管理部门批准的生产工艺进行生产,生产记录必须完整准确。药品生产企业改变影响药品质量的生产工艺的,必须报原批准部门审核批准。
中药饮片必须按照国家药品标准炮制;国家药品标准没有规定的,必须按照省、自治区、直辖市人民政府药品监督管理部门制定的炮制规范炮制。省、自治区、直辖市人民政府药品监督管理部门制定的炮制规范应当报药品监督管理部门备案。
第十一条 生产药品所需的原料、辅料,必须符合药用要求。
第十二条 药品生产企业必须对其生产的药品进行质量检验;不符合国家药品标准或者不按照省、自治区、直辖市人民政府药品监督管理部门制定的中药饮片炮制规范炮制的,不得出厂。
第十三条 经省、自治区、直辖市人民政府药品监督管理部门批准,药品生产企业可以接受委托生产药品。
扩展资料
《药品生产质量管理规范》
第二十九条 研制新药,必须按照药品监督管理部门的规定如实报送研制方法、质量指标、药理及毒理试验结果等有关资料和样品,经药品监督管理部门批准后,方可进行临床试验。药物临床试验机构资格的认定办法,由药品监督管理部门、卫生行政部门共同制定。
完成临床试验并通过审批的新药,由药品监督管理部门批准,发给新药证书。
第三十条 药物的非临床安全性评价研究机构和临床试验机构必须分别执行药物非临床研究质量管理规范、药物临床试验质量管理规范。
药物非临床研究质量管理规范、药物临床试验质量管理规范由确定的部门制定。
第三十一条 生产新药或者已有国家标准的药品的,须经药品监督管理部门批准,并发给药品批准文号;但是,生产没有实施批准文号管理的中药材和中药饮片除外。实施批准文号管理的中药材、中药饮片品种目录由药品监督管理部门会同中医药管理部门制定。
药品生产企业在取得药品批准文号后,方可生产该药品。
第三十二条 药品必须符合国家药品标准。中药饮片依照本法第十条第二款的规定执行。
药品监督管理部门颁布的《中华人民共和国药典》和药品标准为国家药品标准。
药品监督管理部门组织药典委员会,负责国家药品标准的制定和修订。
药品监督管理部门的药品检验机构负责标定国家药品标准品、对照品。
第三十三条 药品监督管理部门组织药学、医学和其他技术人员,对新药进行审评,对已经批准生产的药品进行再评价。
第三十四条 药品生产企业、药品经营企业、医疗机构必须从具有药品生产、经营资格的企业购进药品;但是,购进没有实施批准文号管理的中药材除外。
第三十五条 国家对品、精神药品、医疗用毒品、放射品,实行特殊管理。管理办法由制定。
第三十六条 国家实行中药品种保护制度。具体办法由制定。
第三十七条 国家对药品实行处方药与非处方药分类管理制度。具体办法由制定。
第三十八条 禁止进口疗效不确、不良反应大或者其他原因危害人体健康的药品。
第三十九条 药品进口,须经药品监督管理部门组织审查,经审查确认符合质量标准、安全有效的,方可批准进口,并发给进口药品注册证书。
医疗单位临床急需或者个人自用进口的少量药品,按照国家有关规定办理进口手续。
第四十条 药品必须从允许药品进口的口岸进口,并由进口药品的企业向口岸所在地药品监督管理部门登记备案。海关凭药品监督管理部门出具的《进口药品通关单》放行。无《进口药品通关单》的,海关不得放行。
口岸所在地药品监督管理部门应当通知药品检验机构按照药品监督管理部门的规定对进口药品进行抽查检验,并依照本法第四十一条第二款的规定收取检验费。
允许药品进口的口岸由药品监督管理部门会同海关总署提出,报批准。
第四十一条 药品监督管理部门对下列药品在销售前或者进口时,指定药品检验机构进行检验;检验不合格的,不得销售或者进口:
1、药品监督管理部门规定的生物制品;
2、首次在中国销售的药品;
3、规定的其他药品。
前款所列药品的检验费项目和收费标准由财政部门会同价格主管部门核定并公告。检验费收缴办法由财政部门会同药品监督管理部门制定。
百度百科——药品管理法
第五章 药品管理
第二十九条 研制新药,必须按照药品监督管理部门的规定如实报送研制方法、质量指标、药理及毒理试验结果等有关资料和样品,经药品监督管理部门批准后,方可进行临床试验。药物临床试验机构资格的认定办法,由药品监督管理部门、卫生行政部门共同制定。 完成临床试验并通过审批的新药,由药品监督管理部门批准,发给新药证书。
第三十条 药物的非临床安全性评价研究机构和临床试验机构必须分别执行药物非临床研究质量管理规范、药物临床试验质量管理规范。 药物非临床研究质量管理规范、药物临床试验质量管理规范由确定的部门制定。
第三十一条 生产新药或者已有国家标准的药品的,须经药品监督管理部门批准,并发给药品批准文号;但是,生产没有实施批准文号管理的中药材和中药饮片除外。实施批准文号管理的中药材、中药饮片品种目录由药品监督管理部门会同中医药管理部门制定。 药品生产企业在取得药品批准文号后,方可生产该药品。
第三十二条 药品必须符合国家药品标准。中药饮片依照本法第十条第二款的规定执行。 药品监督管理部门颁布的《中华人民共和国药典》和药品标准为国家药品标准。 药品监督管理部门组织药典委员会,负责国家药品标准的制定和修订。 药品监督管理部门的药品检验机构负责标定国家药品标准品、对照品。
第三十三条 药品监督管理部门组织药学、医学和其他技术人员,对新药进行审评,对已经批准生产的药品进行再评价。
第三十四条 药品生产企业、药品经营企业、医疗机构必须从具有药品生产、经营资格的企业购进药品;但是,购进没有实施批准文号管理的中药材除外。
第三十五条 国家对品、精神药品、医疗用毒品、放射品,实行特殊管理。管理办法由制定。
第三十六条 国家实行中药品种保护制度。具体办法由制定。
第三十七条 国家对药品实行处方药与非处方药分类管理制度。具体办法由制定。
第三十八条 禁止进口疗效不确、不良反应大或者其他原因危害人体健康的药品。
第三十九条 药品进口,须经药品监督管理部门组织审查,经审查确认符合质量标准、安全有效的,方可批准进口,并发给进口药品注册证书。医疗单位临床急需或者个人自用进口的少量药品,按照国家有关规定办理进口手续。
第四十条 药品必须从允许药品进口的口岸进口,并由进口药品的企业向口岸所在地药品监督管理部门登记备案。海关凭药品监督管理部门出具的《进口药品单》放行。无《进口药品单》的,海关不得放行。 口岸所在地药品监督管理部门应当通知药品检验机构按照药品监督管理部门的规定对进口药品进行抽查检验,并依照本法第四十一条第二款的规定收取检验费。 允许药品进口的口岸由药品监督管理部门会同海关总署提出,报批准。
第四十一条 药品监督管理部门对下列药品在销售前或者进口时,指定药品检验机构进行检验;检验不合格的,不得销售或者进口:
(一)药品监督管理部门规定的生物制品;
(二)首次在中国销售的药品;
(三)规定的其他药品。 前款所列药品的检验费项目和收费标准由财政部门会同价格主管部门核定并公告。检验费收缴办法由财政部门会同药品监督管理部门制定。
第四十二条 药品监督管理部门对已经批准生产或者进口的药品,应当组织调查;对疗效不确、不良反应大或者其他原因危害人体健康的药品,应当撤销批准文号或者进口药品注册证书。 已被撤销批准文号或者进口药品注册证书的药品,不得生产或者进口、销售和使用;已经生产或者进口的,由当地药品监督管理部门监督销毁或者处理。
第四十三条 国家实行药品储备制度。 国内发生重大灾情、疫情及其他突发事件时,规定的部门可以紧急调用企业药品。
第四十四条 对国内供应不足的药品,有权限制或者禁止出口。
第四十五条 进口、出口品和国家规定范围内的精神药品,必须持有药品监督管理部门发给的《进口准许证》、《出口准许证》。
第四十六条 新发现和从国外引种的药材,经药品监督管理部门审核批准后,方可销售。
第四十七条 地区性民间习用药材的管理办法,由药品监督管理部门会同中医药管理部门制定。
第四十八条 禁止生产(包括配制,下同)、销售假药。 有下列情形之一的,为假药:
(一)药品所含成份与国家药品标准规定的成份不符的;
(二)以非药品冒充药品或者以他种药品冒充此种药品的。 有下列情形之一的药品,按假药论处:
(一)药品监督管理部门规定禁止使用的;
(二)依照本法必须批准而未经批准生产、进口,或者依照本法必须检验而未经检验即销售的;
(三)变质的;
(四)被污染的; (五)使用依照本法必须取得批准文号而未取得批准文号的原料药生产的;
(六)所标明的适应症或者功能主治超出规定范围的。
第四十九条 禁止生产、销售劣药。 药品成份的含量不符合国家药品标准的,为劣药。 有下列情形之一的药品,按劣药论处:
(一)未标明有效期或者更改有效期的;
(二)不注明或者更改生产批号的;
(三)超过有效期的;
(四)直接接触药品的包装材料和容器未经批准的;
(五)擅自添加着色剂、防腐剂、香料、矫味剂及辅料的;
(六)其他不符合药品标准规定的。
第五十条 列入国家药品标准的药品名称为药品通用名称。已经作为药品通用名称的,该名称不得作为药品商标使用。
第五十一条 药品生产企业、药品经营企业和医疗机构直接接触药品的工作人员,必须每年进行健康检查。患有传染病或者其他可能污染药品的疾病的,不得从事直接接触药品的工作。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。












