药品fda认证是什么意思-原料药fda认证

出口美国的产品种类纷繁复杂。在美国不同的产品由不同的职能部门进行监管。若产品为食品(包括宠物食品和动物饲料)、膳食补充剂、药品、医疗器械、兽药和化妆品、辐射类电子产品、疫苗、生物医药制剂、血液制剂,食品接触材料等,则这些产品受FDA的监管。企业在出口这些产品到美国之前必须要完成FDA认证,否则货物在抵达美国港口时将会面临被FDA扣留,甚至拒绝入境等风险。另外中国出口到美国比较多的农产品则由美国农业(USDA)部监管,企业需要在出口前完成USDA的认证才能顺利清关。另外,常见的出口比较多的有机食品,也受美国农业部监管,也需要在出口前完成USDA的认证。而常见的一些日化产品及消杀类的产品则可能受美国环保署(EPA)的监管,需要在出口前完成EPA认证。还有一些复合型的产品则可能会受到多个部门的联合监管。
出口到美国需要什么认证
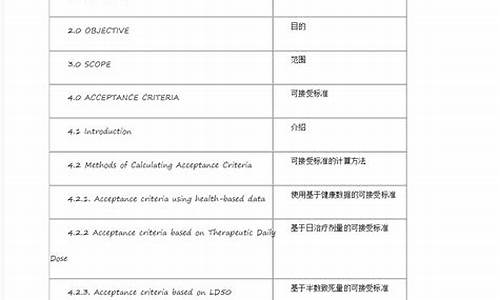
GMP是英文单词Good Manufacturing Practices的缩写,即《药品生产质量管理规范》。它是一套适用于制药、食品等行业的强制性标准,要求企业从原料、人员、设施设备、生产过程、包装运输、质量控制等方面按国家有关法规达到卫生质量要求,形成一套可操作的作业规范帮助企业改善企业卫生环境,及时发现生产过程中存在的问题,加以改善。
COS(Certificate of Suitability)指的是欧洲药典适用性认证,目的是考察欧洲药典是否能够有效地控制进口药品的质量,这是中国的原料药合法地被欧盟的最终用户使用的另一种注册方式。这种注册途径的优点是不依赖于最终用户,可以由原料药生产厂商独立地提出申请。中国的原料药生产厂商可以向欧盟药品质量指导委员会(EDQM)提交产品的COS认证文件(COS Dossier),申请COS证书,同时生产厂商必须要承诺产品生产的质量管理严格遵循GMP标准,在文件审查和可能的现场考察通过之后,EDQM会向原料药品的生产厂商颁发COS证书。如果作为最终用户的欧盟成员国制剂生产企业准备采用中国生产的原料时,只要在注册文件或变更文件中附上该产品的COS证书复印件即可非常容易地获得批准。
FDA是美国食品药物管理署的英文缩写,英文全称为:Food and Drug Administration,它是由美国国会即联邦政府授权,专门从事食品与药品管理的最高执法机关。FDA是一个由医生、律师、微生物学家、药理学家、化学家和统计学家等专业人事组成的致力于保护、促进和提高国民健康的政府卫生管制的监控机构。通过FDA认证的食品、药品、化妆品和医疗器具对人体是确保安全而有效的。在美国等近百个国家,只有通过了FDA认可的药品、器械和技术才能进行商业化临床应用。
什么是DMF认证
企业出口食品到美国,需要拿到FDA的注册。 FDA是美国政府在健康与人类服务部 (DHHS) 和公共卫生部 (PHS) 中设立的执行机构之一。FDA注册是食品出口的必备要求。点击免费了解FDA法规要求
美国FDA要求所有从事制造、加工、包装或储存将在美国消费的食品、饮料或膳食补充品必须向美国食品药品管理局(FDA)注册。非美国的生产企业必须指定美国法定代理与FDA联络。食品出口美国需要的手续:
1、出口商品加工厂到当地出入境检验检疫局备案。
2、申请FDA注册
3、办理清关手续
企业出口食品到美国,需要拿到FDA的注册。 FDA是美国政府在健康与人类服务部 (DHHS) 和公共卫生部 (PHS) 中设立的执行机构之一。FDA注册是食品出口的必备要求。点击免费了解FDA法规要求
美国FDA要求所有从事制造、加工、包装或储存将在美国消费的食品、饮料或膳食补充品必须向美国食品药品管理局(FDA)注册。非美国的生产企业必须指定美国法定代理与FDA联络。食品出口美国需要的手续:
1、出口商品加工厂到当地出入境检验检疫局备案。
2、申请FDA注册
3、办理清关手续
GMP认证与FDA验厂有何不一样?如何建立相关管理体系?
一、DMF概念
DMF即Drug Master File译为“药品主文件”,它是反映药品生产和质量管理方面的一套完整的文件资料。主要包括生产厂简介、具体质量规格和检验方法、生产工艺和设备描述、质量控制和质量管理等方面的内容。
在美国,虽然FDA没在正式文件中规定出口到美国的原料厂家必须上报DMF资料,但实际上大家都在做,而且美国FDA也发表了编写DMF文件的指南。若该原料药被用做处方药的成分时,则美国FDA一定会派人员对生产厂家进行检查,以确定该厂的生产是否与上报资料所述相符,是否是按美国CGMP(良好生产规范)要求进行。鉴于欧共体和美国对进口原料药的严格的管理,编写一份符合要求的DMF文件对促进原料药的出口是至关重要的。
二、DMF类型
DMF文件共有五种类型:
(1)I型,生产地点和厂房设施、人员;
(2)II型,中间体、原料药和药品;
(3)III型,包装物料;
(4)IV型,辅料、着色剂、香料、香精及其它添加剂;
(5)V型,非临床数据资料和临床数据资料。
三、DMF注册优势
1.简化了制剂厂家申请的内容,直接以DMF备案号来代替制剂申请资料中有关单元的具体资料,减少了因向众多制剂客户提供资料而造成企业技术秘密外泄的风险;
2.?取得DMF备案号的企业和其产品均会在FDA网站上公示,持有FDA给予的DMF备案号可以吸引更多的制剂客户共建合作发展关系,并在企业的竞争中被制剂客户优先考虑而获得竞争优势。
想要了解更多有关于FDA药品注册/认证的相关信息,可以联系我司 #Registrar Corp#
通过美国FDA审核后对企业有何好处?
GMP是为确保药品质量万无一失,对药品生产中影响质量的各种因素所规定的一系列基本要求,企业只有通过GMP认证才能生产药品,GMP适用于药品制剂生产的全过程,原料药生产中影响成品质量的关键工序。1963年美国FDA以法令的形式正式颁布,中国从上世纪80年代开始引入GMP概念,在医药企业中推行,现在中国也以法律的形式对药企进行强制认证。GMP已是国际公认的对药品生产进行标准化管理的规范性文件。针对制药企业按质量管理的内容,把影响药品质量的因素分成三大部分:第一是硬件,如厂房、设施、设备。第二是软件,如工艺、文件、记录。第三是人员。
GMP是英文 GOOD MANUFACTURING PRACTICE 的缩写,中文含义是“产品生产质量管理规范”。世界卫生组织将GMP定义为指导食物、药品、医疗产品生产和质量管理的法规。
GMP是一套适用于制药、食品等行业的强制性标准,要求企业从原料、人员、设施设备、生产过程、包装运输、质量控制等方面按国家有关法规达到卫生质量要求,形成一套可操作的作业规范帮助企业改善企业卫生环境,及时发现生产过程中存在的问题,加以改善。简要的说,GMP要求制药、食品等生产企业应具备良好的生产设备,合理的生产过程,完善的质量管理和严格的检测系统,确保最终产品质量(包括食品安全卫生)符合法规要求。
中国卫生部于1995年7月11日下达卫药发(1995)第35号"关于开展药品GMP认证工作的通知"。药品GMP认证是国家依法对药品生产企业(车间)和药品品种实施GMP监督检查并取得认可的一种制度。虽然国际上药品的概念包括兽药,但只有中国和澳大利亚等少数几个国家是将人用药GMP和兽药GMP分开的。
药品GMP认证分为国家和省两级进行,根据《中华人民共和国药品管理法实施条例》的规定,省级以上人民政府药品监督管理部门应当按照《药品生产质量管理规范》和药品监督管理部门规定的实施办法和实施步骤,组织对药品生产企业的认证工作;符合《药品生产质量管理规范》的,发给认证证书。其中,生产注射剂、放射品和药品监督管理部门规定的生物制品的药品生产企业的认证工作,由药品监督管理部门负责。
对于大部分生产出口美国的产品来说,其实不存在FDA认证的,即便通过了FDA验厂审核,或者FDA审核通过了510(k),美国FDA也会声明这不属于FDA的认证或者认可。但是,FDA的审核对于其管辖的产品能否进入美国市场以及是否可以继续进入美国市场,往往起决定作用。
美国FDA是指美国食品药品管理局,其管辖的产品有食品、食品接触材料、药品、药品成分、化妆品、医疗器械、激光产品、烟草制品。根据不同的产品类型,FDA有不同的监管方式,您提到的FDA审核,对于不同的产品和企业来说意义不同,因为FDA可能是对产品审核,也可能是对工厂审核。
对风险等级最高(Class III)的医疗器械、仿制药或者新药、新膳食补充成分、部分公认的安全物质、部分食品接触材料等,只有获得了美国FDA的审核批准以后,才能在美国上市,即对于这些产品来说,获得批准是敲门砖之一;如若没有获得批准,那么进入美国就是不合法的,美国FDA也将会对不合法进入美国的产品采取行动进行监管,包括拒绝货物入境、将企业加入黑名单、发送警告信等等,并将企业公布于官网。
此外,FDA注重上市后监管,若企业已经完成了正规的注册,上述的这些产品类型也获得了批准,那么进入美国以后,也有被抽到工厂审核的概率。药品被审核工厂的概率相较于其他类型产品的工厂高,但是美国FDA默认企业在FDA注册登记时就已经符合了FDA的GMP或者cGMP 的要求,无论是药品、食品还是绝大部分的医疗器械等。因此,如果此时企业在接到FDA审核工厂的通知以后,不回应或者拒绝FDA的验厂,FDA都是有权采取对企业货物加大抽查力度、拒绝入境甚至将企业加入黑名单等行动;若企业经过FDA的验厂审核以后,有严重不符合GMP或者cGMP要求的不符合项,那么FDA是有权对这些企业采取加入黑名单、签发警告信、拒绝货物入境等行动。所以,通过FDA验厂审核是产品进入美国的另外一个基本而且关键的要求。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。