原料药是否需要注册使用许可证-原料药是否需要注册使用

请问您问的是“原料药生产企业获得化学原料药批准通知书后,经核准需要哪几个注册”这个问题吗?该类企业经核准需要的注册如下:
1、药品生产企业需要按照《药品注册管理办法》等相关法规和规定。
2、药品生产企业需要持有《药品生产许可证》。
3、药品生产企业需要持有《药品GMP证书》,这证明企业的生产过程符合药品生产的要求。
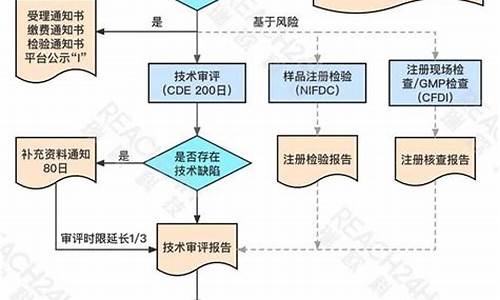
请教关于药品注册列表系统的问题
化药3+3类中前一个3是指原料药按3类注册申报,后一个3是指制剂也按3类注册申报;化药4+4类是指原料药按4类注册申报,其制剂按4类注册申报;化药3+6是指原料药按3类注册申报,其制剂按6类注册申报.
几加几,就指原料药按几类注册申报,其制剂按几类注册申报。
扩展资料
化学药品具体的注册分类办法如下:
一、化学药品注册分类
1、未在国内外上市销售的药品:
(1)通过合成或者半合成的方法制得的原料药及其制剂;
(2)天然物质中提取或者通过发酵提取的新的有效单体及其制剂;
(3)用拆分或者合成等方法制得的已知药物中的光学异构体及其制剂;
(4)由已上市销售的多组份药物制备为较少组份的药物;(5)新的复方制剂。
2、改变给药途径且尚未在国内外上市销售的制剂。
3、已在国外上市销售但尚未在国内上市销售的药品:
(1)已在国外上市销售的原料药及其制剂;
(2)已在国外上市销售的复方制剂;
(3)改变给药途径并已在国外上市销售的制剂。
4、改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药及其制剂。
5、改变国内已上市销售药品的剂型,但不改变给药途径的制剂。
6、已有国家药品标准的原料药或者制剂。
百度百科-化学药品
1.是不是每向FDA递交一个产品的DMF文件,都需要进行一次Drug Establishment Registration and Drug Listing操作?
不需要,Establishment Registration 除了首次注册,就是每年一次的年度注册,需要在12月底前完成。Drug Listing在每年的六月和十二月分别做一次。当然FDA鼓励在这期间,如果有增加新产品或者已列产品有变化,可以进行额外的Drug Listing登记。
2.原料药是不需要注册NDC号的吧?
NDC号主要针对成品,从其定义可见“The NDC is a unique nuber assigned to drug products”。但实际上,原料药也是可以申请NDC号的,只是不会出现在FDA的NDC Directory里面。原料药的NDC号主要用于美国海关的进口登记。
NDC号是药品在美国流通所必需的,API进入美国市场时必须要有DNC号。但是标签上不是必须要有NDC号的。
CFR中的原话:
FDA requests but does not require that the NDC number appear on all drug labels and in other drug labeling, including the label of any drug container furnished to a consumer.
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。