原料药备案登记平台-原料药购买备案流程是什么
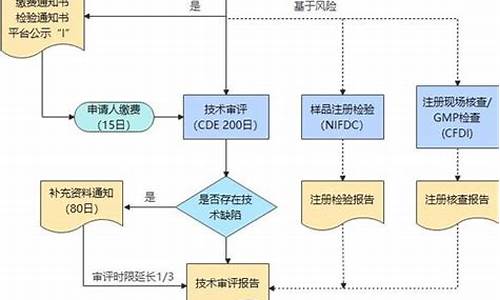
药物立项调研都是要查询数据的,从调研药物基本信息(理清适应症,确定参比制剂)-国内外上市情况(分析对手,评估注册难度)-专利查询(避免侵权)-临床优势(临床优势越好,市场越大)-法规可行性(降低项目成本)-市场数据(分析市场前景,计算投入产出比)-原料药到决策分析等,无疑这些数据都需要医药数据库查询,以下简单介绍以下调研步骤。
药物立项步骤
1、调研药物基本信息
可以在一致性评价数据库下,查询原研药物数据,可以在“橙皮书”或者“仿制药参比制剂目录”查询,这一步能确定药物的参比制剂,在全球上市药品可以查询药品的说明书这些主要目的是为了:理清适应症,确定参比制剂。
原研数据(参比制剂)
2、调研国内外上市情况
可以在中国药品审评和中国药品批文查询国内药物上市和未上市的情况,在全球上市药物数据中查询,这一步的主要目的是分析竞争情况,查询竞争对手数量。还能分析过审的难度,这些在药监局也能查询但是综合的数据库数据更加全面,更加的利于分析。
这一部分主要查询上市受理情况和一致性评价情况(分析竞争对手),临床备案情况(申报进度以及BE难度)以及CDE原料药的备案情况,这些主要让我们对于自己的项目有个大概的认知。
国内外上市情况
3、调研专利数据
专利数据这一点是非常重要的,专利产权问题是药企的核心点之一,调研专利需要调研核心专利,同族专利、工艺专利等等,这些可能需要团队的配合,可以在全球专利数据和中国专利数据查询,主要目的是:避免专利侵权
专利数据调研
4、调研临床优势
药品的临床安全性,优势越大,那么这个药品的市场就越大,可以在临床数据库中查询药物的安全性,可以分辨药物临床优势。
5、查询市场数据
查询市场数据,查询药物销售数据,这些都是需要专业的数据库,还有一种方法是可以在上市企业年报查询,还能在微信公众号查询碎片化的数据,还能在各大财富网站了解,以及雪球了解,但是这些数据唯一就是数据精准度不高,整合麻烦,可以通过查询药品在药店和在医院的销售数据:分析市场前景,计算投入和产出比。
市场数据
6、查询原料药情况
可以查询原料药基本信息(最佳合成路线,中间体、试体等),质量标准查询、可行性查询,这些主要是为了进行技术评估,进入最后阶段,可以在原料药数据库里查询到这些数据。
最后就是项目评估、决策阶段了,数据库能帮助药物立项调研中所有想要了解的数据,为立项调研提供决策,为药物研发提供支持,当然数据库也能为医药投资做出决策。
美国原料药fda认证需要多长时间
在网上开网店卖中药材需要办理药品经营许可证和营业执照。
根据《中华人民共和国电子商务法》第十条 电子商务经营者应当依法办理市场主体登记。但是,个人销售自产农副产品、家庭手工业产品,个人利用自己的技能从事依法无须取得许可的便民劳务活动和零星小额交易活动,以及依照法律、行政法规不需要进行登记的除外。
第十二条 电子商务经营者从事经营活动,依法需要取得相关行政许可的,应当依法取得行政许可。
第十三条 电子商务经营者销售的商品或者提供的服务应当符合保障人身、财产安全的要求和环境保护要求,不得销售或者提供法律、行政法规禁止交易的商品或者服务。
扩展资料:
《药品经营许可证管理办法》第六条 开办药品批发企业验收实施标准由国家食品药品监督管理总局制定。开办药品零售企业验收实施标准,由各省、自治区、直辖市食品药品监督管理部门依据本办法和《药品经营质量管理规范》的有关内容组织制定,并报国家食品药品监督管理总局备案。
第七条 药品经营企业经营范围的核定。药品经营企业经营范围:品、精神药品、医疗用毒品;生物制品;中药材、中药饮片、中成药、化学原料药及其制剂、抗生素原料药及其制剂、生化药品。
从事药品零售的,应先核定经营类别,确定申办人经营处方药或非处方药、乙类非处方药的资格,并在经营范围中予以明确,再核定具体经营范围。医疗用毒品、品、精神药品、放射品和预防性生物制品的核定按照国家特殊药品管理和预防性生物制品管理的有关规定执行。
百度百科——中华人民共和国电子商务法
进口原料药需要什么公司资质
百度名字,这个的话是需要看你资料整理时间以及生产现场准备工作时间,FDA的资料审查时间很守时,说六个月就是六个月,不像中国的CFDA原料药注册也很麻烦。,还有注意的就是你申报的是几类产品,是新药还是仿制药。 这样如果你们厂是出口的话,建议先备案一个DMF,获得备案号之后就会在美国FDA官网展示,如果客户急需获得认证出口,那你们就必须备案后立刻进行审查,也是包括文件和现场。 如果只是原料药出口获得允许还是不算太难,难就是制剂在美国申报。具体还有好多值得注意的,一直说不清楚,可以一起讨论,ME就是做这个的 ,国际注册
原料药DMF是什么
通俗点来讲,一般贸易进口就是要安排海关的监管条件去操作进口手续,包括监管条件下需要的单证和流程。
进口原料药需要的企业资质和资料有: 1、《药品经营许可证》或《药品生产许可证》 2、《企业法人营业执照》 3、《进口药品注册证》或者《医药产品注册证》(正本或副本) 4、进口药品报检单 5、《进口药品通关单》 6、企业进出口权,对外贸易经营者备案表 企业进口药品时,应注意到达哪个口岸,并核查该口岸是否具备药品进口条件;因为不是所有口岸都允许进口药品,应选择已获国家批准的口岸入境。药品登记号和药品备案号有什么区别
药物管理档案(Drug Master Files, DMF)是一份提交给美国FDA的保密文件,它提供了关于用于生产药物的原料、活性中间体及其设施、流程、包装及仓储等相关的信息。FDA目前接受书面递交和电子递交(eCTD)两种格式。点击免费了解FDA法规要求
DMF的主要的种类有:
I型,生产地点和厂房设施、人员(已取消);
II型,中间体、原料药和药品;
III型,包装物料;
IV型,辅料、着色剂、香料、香精及其它添加剂;
V型,非临床数据资料和临床数据资料。
虽然美国FDA没在正式文件中规定出口到美国的厂家必须上报DMF资料,但是若该产品被用做处方药时,美国FDA会派官员对生产厂家进行检查,以确定该厂的生产是否与上报资料所述相符,是否是按美国cGMP(现行GMP)要求进行生产。美国的DMF文件库是全世界制剂厂家广泛参照的一个供应商资源库,所以几乎所有想让产品推向国际的制药厂都进行DMF备案。DMF注册后有以下几个优势:
1 简化了制剂厂家申请的内容,直接以DMF备案号来代替制剂申请资料中有关单元的具体资料,减少了因向众多制剂客户提供资料而造成企业技术秘密外泄的风险;
2 取得DMF备案号的企业和其产品均会在FDA网站上公示,持有FDA给予的DMF备案号可以吸引更多的制剂客户共建合作发展关系,并在企业的竞争中被制剂客户优先考虑而获得竞争优势;
作用不同。
药品登记号是生产或者已有国家标准的东西的,须经监督管理部门批准,并在批准文件上规定该产品的专有编号,此编号称为批准文号,而药品备案号,针对补充申请而言,如改变说明书、包材、原料产地,生产地址等很多需要重新完善的工作,前者是登记申请注册的,后者是补充申请,两者的区别就是其作用不同。
药品是用来预防、治疗、诊断疾病,有目的地调整人体生理机能,并规定有适应症或功能主治、用法、用量的物质。药品包括中药材、中成药、化学原料药及其制剂、抗生素、生化药品、放射品、血清、疫苗、血液制品及诊断药品等。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。