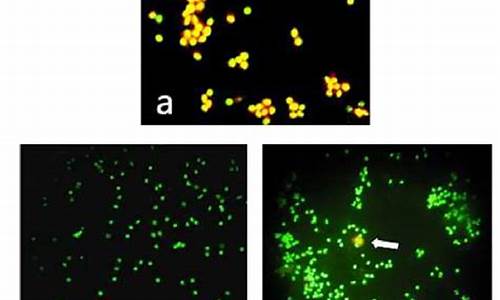
吖啶橙染色法-吖啶橙染色细胞自噬图片
碘化丙啶(propiolium iodide,PI)能嵌入DNA双螺旋中,可使荧光强度增加约20倍,以488nm波长激发,DNA/PI复合物最大的发射波长约为615nm。
小鼠Lewis肺癌细胞DNA含量测定方法
(1).从C57BL/6小鼠上切除肿块,在培养皿内用PBS冲洗。
(2).去除结缔组织及,剪碎肿块。
(3).小碎片移入1.20×38mm针,加压使其通过,于4℃条件下重悬细胞于HBSS中。
(4).将200~300μL细胞悬液(5×105细胞/mL)中加入3mL PI(50μg/mL),染色3LL细胞,于4℃存放20~30分钟。
(5).测定580~750nm之间的发射荧光,以去除末结合PI产生的激发光与发射光谱线之间的重叠部分。
注:PI染色液:0.1%柠檬酸钠1000mL+PI 5mg + 1% Nonide P40水。
2. 培养细胞DNA的流式细胞仪分析
(1).从培养皿中吸去培养基,以HBSS冲洗二次。
(2).加入PI5mL于培养皿中,在4℃放10分钟。
(3).用吸管反复次打细胞,使细胞破坏,胞核释放出来,再行流式细胞仪分析。
3. 完整细胞DNA的PI染色
(1).70%乙醇固定的细胞悬液,离心,去固定液。
(2).室温条件下加入PI染色一批细胞(105~106细胞/mL),时间为30分钟,然后行流式细胞仪分析。
(二)吖啶橙染色
1. DNA和RNA的鉴别染色
利用吖啶橙的变色特性可鉴别DNA和RNA。吖啶橙作为一种荧光染料已被用于染色固定,非固定细胞核酸,或作溶酶体的一种标记。观察亡细胞荧光变色性变化以及区别分裂细胞和静止细胞群体。虽然测定DNA和RNA含量时较难获得好的重复性结果,但该方法已被许多实验室广泛采用。方法如下:
1)试剂:
(1)溶液A:低温保存,稳定期约2周。
Triton X-100(0.1%) 0.1mL,1mol/L HCL 8mL?
1mol/L NaCL 15ml蒸馏水76mL,P
细菌有哪些染色方法?
带型(banding
pattern)
即染色体带型。借助细胞学的特殊处理程序,使染色体显现出深浅不同的染色带。染色带的数目、部位、宽窄和着色深浅均具有相对稳定性,所以每一条染色体都有固定的分带模式,即称带型。染色体带型是鉴别染色体的重要依据。通过分带机理的研究,可获得染色体在成分、结构、行为和功能等方面的许多信息。染色体分带的研究工作始于60年代末。染色体分带技术就是经理化因素处理后,用染色法使染色体呈现特定的深浅不同的带纹的方法,又称显带技术。而用一般细胞学染色法,染色体的着色是均匀的。经分带技术处理后,在染色体上所呈现的带纹反映了染色体的固有结构,可显示不同物种染色体的差异或同一物种不同染色体的差异。常用的显带技术所显示的带有Q带、G带、C带、R带、T带等。就每一种分带技术而言,每一染色体的带型是高度专一和恒定的。Q带技术是1968年瑞典细胞化学家卡斯珀松(T.Caspersson)建立的,所显示的是中期染色体经芥子喹吖因染色后在紫外线照射下所呈现的荧光带,这些区带相当于DNA分子中AT碱基对成分丰富的部分。G带即吉姆萨带,是将处于分裂中期的细胞经胰酶或碱、热、尿素等处理后,再经吉姆萨染料染色后所呈现的区带。C带又称着丝粒异染色质带,由(M.L.Pardue)在1970年建立,是将中期染色体先经盐酸,后经碱(如氢氧化钡)处理,再用吉姆萨染色,显示的是紧邻着丝粒的异染色质区。R带是中期染色体不经盐酸水解或不经胰酶处理的情况下,经吉姆萨染色后所呈现的区带,所呈现的是G带染色后的带间不着色区,故又称反带。T带又称端粒带,是染色体的端粒部位经吉姆萨和吖啶橙染色后所呈现的区带,典型的T带呈绿色。70年代后期,由于细胞同步化方法的应用和显带技术的改进,因而可获得更长而带纹更为丰富的染色体,这种染色体即称为高分辨染色体。例如1975年以后,美国细胞遗传学家龙尼斯(J.J.Ron-neys)等建立了高分辨显带法,先用氨甲喋呤使细胞分裂同步化,然后用秋水酰胺进行短时间处理,使之出现大量的晚前期和早中期的分裂相。早期染色体比正中期染色体长,显带后可制出分带细、带纹更多的染色体。例如在前中期分裂相可显示555~842条带,晚前期可显示843~1256条带,而从早前期获得的更长的染色体上可显示出3000~10000条具有分辨程度更高的带型。高分辨技术能为染色体及其畸变提供更多的细节,有助于发现更多细微的染色体异常,可对染色体的断裂点作更为精确的定位,这些对基因图的详细绘制有重要价值。总之,无论在细胞遗传学和遗传学理论研究中,还是在医疗诊断、动植物育种等方面,分带技术都是一种用途广泛的重要技术。
吖啶橙的介绍
一、常用的染色方法有革兰氏染色(最基本)、芽孢染色、荚膜染色、鞭毛染色等。
二、.1 革兰染色法 (1)取含金**葡萄球菌和大肠埃希菌的混合菌液涂片、干燥、固定;(2)染色:用结晶紫染液染1min,水冲洗;卢戈碘液染1min,水冲洗;0.4%复红酒精溶液染30s,水冲洗;(3)吸干后镜检[2] 。
1.2 抗酸染色法 (1)取结核杆菌阳性的痰标本(已处理)涂片、干燥、固定。(2)染色:将石炭酸复红染液沸水浴10min,滴加2~3滴覆盖菌膜染色 5min,水冲洗,3%盐酸酒精脱色30s,水冲洗;碱性美兰复染30s,水冲洗。(3)吸干后镜检[3] 。
1.3 荚膜染色法 (1)取接种肺炎球菌亡的小鼠腹腔液涂片、干燥、固定;(2)染色:用石炭酸复红染液染1min,水冲洗;95%酒精脱色5s水冲洗;20%鞣酸溶液媒染10min水冲洗;0.8%孔雀绿溶液染色1min,水冲洗;(3)吸干后镜检[4] 。
1.4 芽胞染色法 (1)取等量破伤风杆菌厌氧培养菌液和5%孔雀绿水溶液,放入小试管中充分混合,沸水浴20min;取上述混合液涂片、干燥、固定;(2)用 1%沙黄液复染10min,水冲洗;(3)干后镜检。
2.1 革兰染色 镜下,金**葡萄球菌染成紫色、球形,为革兰阳性菌;大肠埃希菌染成红色、杆状,为革兰阴性菌。革兰染色法是细菌学中最经典,应用最广泛的染色法之一。脱色是影响革兰染色的关键步骤,脱色时间长短直接关系到染色结果的准确性[5] 。脱色过度则革兰阳性菌可能被误染为革兰阴性菌,脱色不 够则革兰阴性菌可能被误染为革兰阳性菌,为此学生难以把握。现将原有四步染色法改为三步法,即把第三步酒精脱色和第四步复红复染合并一步进行,使用 0.4%复红酒精溶液作为复染剂,可达到脱色和复染双重目的。这样,就可以避免学生在四步法中因脱色时间不易掌握而造成染色的失败,减少重复性实验,提高了教学效果。
2.2 抗酸染色 镜下,结核分枝杆菌染成红色,为抗酸菌;背景和其他菌被染成蓝色,为非抗酸菌。传统的方法是滴加石炭酸复红染液于涂片上,用玻片夹夹住涂片以微火烟叶热,保持染液冒蒸汽约5min,此法学生容易使染液蒸干或使染液沸腾,从而影响染色效果和污染环境。改良后的方法是将染液直接加热改为水浴后使用,克服上述的缺点,且染色效果良好。适合实验教学使用。
2.3 荚膜染色 镜下,肺炎球菌菌体染成红色(成双排列),荚膜染成绿色,存在于菌体的周围。传统的荚膜染色是用结晶紫染液染色,菌体染成紫色,荚膜染成淡紫色或无色,菌体和荚膜之间反差小,不易分辨。改良后,增加了脱色、媒染、复染的步骤,使菌体和荚膜之间反差增大,易于观察,可用于学生实验和示教片的制作。
2.4 芽胞染色 镜下,破伤风杆菌的菌体染成红色,芽胞染成绿色。传统的方法是滴加石炭酸复红染液于涂片上并弱火加热,使染液冒蒸汽约5min,此法染液用量大,且容易污染衣物和实验台。现改为菌液和染液混合水浴加热初染,然后制备涂片、固定、复染,即节约时间,染液消耗又少,且菌体、芽胞对比鲜明。此法适用于教学标本片的制作。
三、简单染色法是利用单一染料对细菌进行染色的一种方法。
操作步骤
1.涂片:用灼烧灭菌冷却后的接种环挑取少量菌体与水滴充分混匀,涂成极薄的菌膜。
2.干燥:可自然晾干,或将涂片置于火焰高处微热烘干,但不能直接在火焰上烘烤。
3.固定:手执玻片一端,有菌膜的一面朝上,通过迅速通过火焰2-3次(用手指触涂片反面,以不烫手为宜)。
4.染色:加适量(以盖满菌膜为度)结晶紫染色液(或石炭酸复红液),染l~2min。
5.水洗:用自来冲洗至流下的水中无染色液的颜色时为止。
6.干燥
7.镜检
caspase是什么
吖啶橙:3,6-(二甲胺基)吖啶盐酸盐,分子式C17H19N3 · HCl · ZnCl?, 分子量438.12g/mol,是一种荧光色素,其检测激发滤光片波长488nm,阻断滤光片波长515nm。它与细胞中DNA和RNA结合量存在差别,可发出不同颜色的荧光,与DNA结合量少发绿色荧光,与RNA结合量多发桔**或桔红色荧光。该染料具有膜通透性,能透过细胞膜,使核DNA和RNA染色。因此,在荧光显微镜下观察,吖啶橙可透过正常细胞膜,使细胞核呈绿色或黄绿色均匀荧光;而在凋亡细胞中,因染色质固缩或断裂为大小不等的片断,形成凋亡小体。吖啶橙使其染上致密浓染的黄绿色荧光,或黄绿色碎片颗粒;而坏细胞黄荧光减弱甚至消失。吖啶橙AO常与溴化乙啶EB合用双染,因EB只染细胞使之产生桔**荧光,由此可区分出正常细胞、凋亡细胞及坏细胞.它还可以用作移码突变的诱变剂,能镶嵌于两个相邻的碱基对之间,这样在DNA复制过程中,会使DNA链增加或缺失一个碱基,造成移码突变。吖啶橙染液有毒,操作时要戴手套,需避光。
吖啶橙染色的叶绿体和细胞核颜色分别是什么
caspases是一组存在于细胞质中具有类似结构的蛋白酶。它们的活性位点均包含半胱氨酸残基,能够特异性切割靶蛋白天冬氨酸残基后的肽键。因此caspases意为“天冬氨酸特异性的半胱氨酸蛋白水解酶”。caspases负责选择性地切割某些蛋白质,切割的结果是使靶蛋白活化或失活,而非完全降解。
核酸电泳染色剂有哪些
叶绿体发出桔红色荧光,细胞核可发出绿色荧光。根据查询公开信息显示,吖啶橙是一种荧光色素,与细胞中 DNA 和 RNA 结合量存在差别,可发出不同颜色的荧光(即着色特异性),这是由于DNA是个高度聚合物,吸收荧光物质的位置较少,发绿色荧光,而RNA 聚合度低,能和荧光物质结合的位置多,故发红色荧光。
实验室中常用的DNA分子量的测定方法有哪些
电泳后,核酸需经染色才能显色出带型,常用以下核酸染色剂:
1、溴化乙锭(ethidium bromide, EB)
最常用的核酸荧光染料,可嵌入核酸双链的配对碱基之间,在紫外线激发下,发出桔红色荧光。 EB-DNA复合物中的EB发出的荧光,比游离的凝胶中的EB发出的荧光强度大10倍,因此无需洗净背景即可清楚观察核酸带型。若EB背景太深,可将凝胶 浸泡于1mmol/LMgSO4中1h或10mmol/L MgCl2中5min,使非结合的EB褪色,这 样可检查到10ng的DNA样品,EB也可用于检测单链DNA或RNA,但其对单链核酸的亲和力相对较小,荧光产率也相对较低。
在凝胶或电泳缓冲液中加入终浓度为0.5μg/ml的EB,染色可在电泳过程中进行,能随时观察核酸的迁移情况。但EB带正电荷,嵌入碱基后增加了 核酸分子的刚性,使迁移率减慢,故不宜用于测定核酸分子量的大小,这时应在电泳后将凝胶浸入0.5μg/ml的EB水溶液中10min进行染色。EB见光 易分解,应于4℃避光保存,
2、吖啶橙(acridine orange, AO):
吖啶橙可嵌入双链核酸碱基对之间,在254nm紫外线激发下发出530nm的绿色荧光;还通过静电与单链核酸的磷酸基结合,在254nm紫外线激发 下产生640nm的红色荧光。因此可区分单链和双链核酸,灵敏度分别为0.1μg和0.05μg。但吖啶橙的染色操作要求严格,应在 22℃,0.01mol/L磷酸钠缓冲液(pH7.0)中避光浸泡30min,然后在搪瓷盘中用该缓冲剂4℃脱色过夜或22℃脱色1~2小时。
3、银(Ag+)试剂:
Ag+与核酸形成稳定复合物,然后用甲醛使Ag+还原成银颗粒。AgNO3等试剂可使聚丙烯酰胺凝胶上的单链,双链DNA及 RNA都染成黑褐色。银染法的灵敏度比EB染色高200倍左右,比亚甲蓝染色高100~1000倍,在小于0.5mm厚的凝胶中,能检测出0.5ng的 RNA,其缺点是专一性不强,能与蛋白质,去污剂反应也产生褐色,而且对DNA的染色定量不准确。银与DNA稳定结合,对DNA有破坏作用,不适于DNA 片段回收的制备。
4、亚甲蓝(methylene blue)
可将RNA染成蓝色,但灵敏度不高,而且操作时间长。染色过程:胶浸泡于0.02%的亚甲蓝,10mmol/L Tris-Ac(pH8.3),4℃放置1~2h,用净水洗5~8h(反复换水),带型肉眼可见,最低检测量为 250ng。
第一种方法最常用
1)紫外吸收法也就是测量OD(260)和OD(280)的吸收值,这样的方法其它的杂质对测量结果影响大一点,因为其它杂质在这两个吸收波长也有吸收.
(2)荧光法,用PicoGreen荧光染料,测定DNA,RNA浓度比较灵敏,并且适合测量低浓度和微量DNA和RNA,并且受其它杂质的影响不大,缺点要有专门的荧光检测仪器,试剂比较昂贵.
纯化DNA可以买试剂盒,主要有膜吸附法,磁珠分离法,都很方便.
RNA与DNA最重要的区别一是RNA只有一条链,二是它的碱基组成与DNA的不同,RNA没有碱基T(胸腺嘧啶),而有碱基U(尿嘧啶).所以导致他们有以下性质上的不同.
1.两性解离:DNA无,只有酸解离,碱基被屏蔽(在分子内部形成了H键).RNA有,有PI.
2.粘度大:DNA;RNA,粘度由分子长度/直径决定,DNA为线状分子,RNA为线团.
3.碱的作用:DNA耐碱RNA易被碱水解.
4.显色反应:
鉴别DNA和RNA+浓HCl RNA ------→ 绿色化合物
DNA ------→ 蓝紫色化合物苔黑酚
二苯胺啡啶溴红(荧光染料)和溴嘧啶都可对DNA染色,原理是卡在分子中,DNA的离心和电泳显色可用它们.
DNA和RNA的鉴别染色
利用吖啶橙的变色特性可鉴别DNA和RNA.吖啶橙作为一种荧光染料已被用于染色固定,非固定细胞核酸,或作溶酶体的一种标记.观察亡细胞荧光变色性变化以及区别分裂细胞和静止细胞群体.虽然测定DNA和RNA含量时较难获得好的重复性结果,但该方法已被许多实验室广泛采用.
5.溶解性:都溶于水而不溶于乙醇,因此,常用乙醇来沉淀溶液中的DNA和RNA.DNA溶于苯酚而RNA不溶,故可用苯酚来沉淀RNA.
6.紫外吸收:核酸的λm=260nm,碱基展开程度越大,紫外吸收就越厉害.当A=1时,DNA:50ug/ml,RNA和单链DNA:40ug/ml,寡核苷酸:20ug/ml.用A260/A280还可来表示核酸的纯度.
7.沉降速度:对于拓扑异构体(核苷酸数目相同的核酸),其沉降速度从达到小依次为:RNA ; 超螺旋DNA > 解链环状DNA ; 松弛环状DNA ; 线形DNA也就是在离心管中最上层是线形DNA,最下面是RNA.
8.电泳:核苷酸、核酸均可以进行电泳,泳动速度主要由分子大小来决定,因此,电泳是测定核酸分子量的好方法.
9.DNA分子量测定最直接的方法:用适当浓度的EB(溴嘧啶)染色DNA,可以将其他形式的DNA变成线形DNA,用电镜测出其长度,按B-DNA模型算出bp数,根据核苷酸的平均分子量就可计算出DNA的分子量.
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。