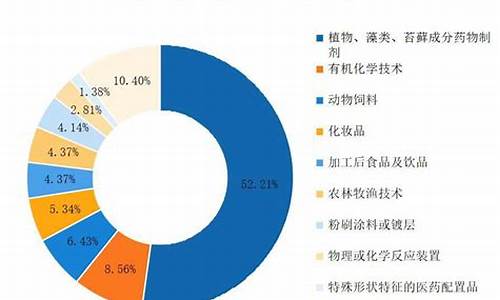
原料药的用途-原料药的来源有哪三大类

植物药产品
是
植物原料药
的产品。注意:植物原料药不包括天然来源的高度提纯或化学修饰的物质。即:纯中药!植物药原料药
是
植物原料药
经制备(提取等工艺)而成。植物原料药
是其原料。
药品原辅料合法来源
原料药的生产过程主要包括的环节:新药研发的探索阶段、小量试制阶段、中试生产阶段、工业化生产阶段。
1、 新药研发的探索阶段
实验室研究阶段会采用反复分馏、多次重结晶、各种层析技术等一切分离纯化手段,来制备少量的样品供药理筛选,很明显这样的合成方法与工业生产的差距很大。实验室研究阶段在化学药研发流程中比较重要。
2、小量试制阶段
新药苗头确定后,要进行小试研究,小试阶段的主要任务是对实验室原有的合成路线和方法进行全面、系统的改革,在改革的基础上通过实验室批量合成、积累数据,提出一条基本适合中试生产的合成工艺路线。
3、 中试生产阶段
根据小试实验研究工业化可行的方案,进一步研究在一定规模的装置中各步化学反应条件的变化规律,并解决实验室所不能解决或发现的问题,为工业化生产提供设计依据。原料药中试生产也是原料药小试生产的扩大。
4、工业化生产阶段
原料药的工业化生产,其重要的目的主要有两个,一是用于相应的制剂生产,二是以原料药及化工原料的形式进行国内外销售。在将工艺由实验室转向工厂、将样品转化成产品的过程中,最关键的阶段无外乎路线优化阶段,这是成功转向生产的基石。
原料药的简介:
原料药在ICH Q7A中的完善定义:旨在用于药品制造中的任何一种物质或物质的混合物,而且在用于制药时,成为药品的一种活性成分。此种物质在疾病的诊断,治疗,症状缓解,处理或疾病的预防中有药理活性或其他直接作用,或者能影响机体的功能或结构。
药剂的有效成分。原料药只有加工成为药物制剂,才能成为可供临床应用的医药。原料药根据它的来源分为化学合成药和天然化学药两大类。天然化学药按其来源,也可分为生物化学药与植物化学药两大类。
化学合成药又可分为无机合成药和有机合成药。无机合成药为无机化合物(极个别为元素),如用于治疗胃及十二指肠溃疡的氢氧化铝、三硅酸镁等;有机合成药主要是由基本有机化工原料,经一系列有机化学反应而制得的药物(如阿司匹林、氯霉素、咖啡因等)。
原料中控制的杂质,制剂中有必要或者必须继续控制吗?依据
药品原辅料合法来源国产原料药应同时具有《药品生产许可证》《药品GMP》证书药品批准文号。根据查询相关公开信息显示,用于生产该制剂的原料药和辅料合法来源的证明文件。原料药和辅料尚未取得国家食品药品监督管理局批准的,应当报送有关生产工艺、质量指标和检验方法等规范的研究资料。
所有化学药品的种类
有,需要继续控制。
原料药是原料药,制剂是制剂。你知道这些杂质是原料药中带入的,只能证明了它的来源。现在对于杂质的要求非常严格,即便是原料药中的杂质也分为:起始物料、中间体或者降解产物等等。
看这个吧,超过了报告限度的杂质,是需要出报告的。超过鉴定限度的杂质是需要知道它具体的化学结构的。
尤其是你在制剂研究、生产过程中监控这些杂质的增长情况。有些杂质在原料药里增长不明显,做成了制剂就蹭蹭地长。到底是湿度影响,还是酸碱度影响,或者是温度影响。这关系到制剂工艺的问题,另外产品贮藏条件,包装条件都是跟主成分含量以及杂质有关系的。
请问,做保健食品的中药提取物,采购来源国家药监局有规定吗?为何市面上多是兽药资质的GMP车间有资格
1、未在国内外上市销售的药品:
(1)通过合成或者半合成的方法制得的原料药及其制剂;
(2)天然物质中提取或者通过发酵提取的新的有效单体及其制剂;
(3)用拆分或者合成等方法制得的已知药物中的光学异构体及其制剂;
(4)由已上市销售的多组份药物制备为较少组份的药物;(5)新的复方制剂。
2、改变给药途径且尚未在国内外上市销售的制剂 。
3、已在国外上市销售但尚未在国内上市销售的药品:
(1)已在国外上市销售的原料药及其制剂;
(2)已在国外上市销售的复方制剂 ;
(3) 改变给药途径并已在国外上市销售的制剂 。
4、改变已上市销售盐类药物的酸根、碱基(或者金属元素),但 不改变其药理作用的原料药及其制剂 。
5、改变国内已上市销售药品的剂型,但不改变给药途径的制 剂 。
6、已有国家药品标准的原料药或者制剂。
扩展资料
结构明确的具有预防、治疗、诊断疾病,或为了调节人体功能、提高生活质量、保持身体健康的特殊化学品。化学药物是以化合物作为其物质基础,以药效发挥的功效(生物效应)作为其应用基础的。
结构确证:
1、说明结构确证测试样品的来源(精制)和纯度
2、对照品的来源:是否合法
3、对含多个手性中心的原料药需确定本品的立体结构,长要求补充进行NOE谱 或其他图谱的测定,或提供本品详细的同样测试条件下的核磁共振文献图谱和数据以进一步确定本品的立体结构。
4、晶型研究发补原则。对于难溶性化合物,制剂为口服固体制剂,同时从文献报道已知晶型对生物利用度或稳定性有明显影响,这种情况应在临床研究前要求进行晶型研究,其它情况可不要求。
百度百科-化学药品
百度百科-化学药物
原料药和新制剂中的杂质,哪些需要对其定性或结构确证
来源没有规定的。
根据2010版GMP原料药第四章规定:
第十五条 应当对每批物料至少做一项鉴别试验。如原料药生产企业有供应商审计系统时,供应商的检验报告可以用来替代其它项目的测试。
第十六条 工艺助剂、有害或有剧毒的原料、其它特殊物料或转移到本企业另一生产场地的物料可以免检,但必须取得供应商的检验报告,且检验报告显示这些物料符合规定的质量标准,还应当对其容器、标签和批号进行目检予以确认。免检应当说明理由并有正式记录。
第十七条 应当对首次采购的最初三批物料全检合格后,方可对后续批次进行部分项目的检验,但应当定期进行全检,并与供应商的检验报告比较。应当定期评估供应商检验报告的可靠性、准确性。
原料药是原料药,制剂是制剂。你知道这些杂质是原料药中带入的,只能证明了它的来源。现在对于杂质的要求非常严格,即便是原料药中的杂质也分为:起始物料、中间体或者降解产物等等。
看这个吧,超过了报告限度的杂质,是需要出报告的。超过鉴定限度的杂质是需要知道它具体的化学结构的。
尤其是你在制剂研究、生产过程中监控这些杂质的增长情况。有些杂质在原料药里增长不明显,做成了制剂就蹭蹭地长。到底是湿度影响,还是酸碱度影响,或者是温度影响。这关系到制剂工艺的问题,另外产品贮藏条件,包装条件都是跟主成分含量以及杂质有关系的。,具体的可以查询药智网,回答满意请您采纳,谢谢。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。