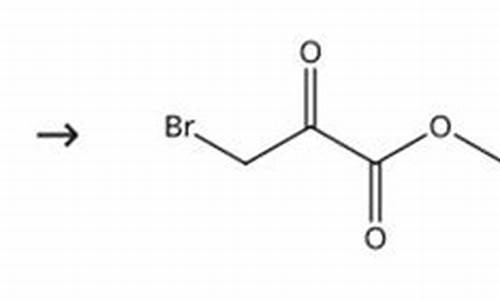
原料药CTD-原料药CTD模板

文 | AI 财经 社健识局 陈广晶
编 | AI 财经 社健识局 严冬雪
本文来源于AI 财经 社旗下医疗大 健康 品牌“健识局”,未经许可,严禁转载
全新的药品监管时代来了。
4月30日,国家药监局官网一口气挂出9大征求意见稿,全面覆盖了境内、境外,化药、生物制品、中药的注册、再注册、上市后临床变更,以及疫苗的生产流通等内容。
按照要求,5月30日前,各界人士可以将反馈意见发送到指定邮箱,而最终形成的文件,将直接影响2个月后所有品类药品的研发、注册、再注册等工作。
2015年以来,以药品审评审批制度改革、仿制药一致性评价等的启动为开端,中国的药品监管已经发生了巨大的变化。
特别是2019年12月1日,新修订的《药品管理法》《疫苗管理法》已经进入执行阶段;药品的注册管理办法、生产管理办法也于3月底完成了时隔13年、18年的首次大规模修订并发布,其中临床试验默许制、串联改并联等,都将极大促进中国的新药创新。
此次发布的一系列配套文件则将最终确保上述利好落地。结合针对非专利药的带量采购、仿制药一致性评价,以及医保目录动态调整等政策,在仿制药、过专利期原研药进入急剧洗牌期的同时,真正具有临床价值的创新产品将迎来研发和市场的黄金时代。
虽然在过渡期,在具体操作中仍然不免存在这样那样的问题,但是不可否认的是,中国药品监管已经开始从侧重事前监管向以患者为中心的全流程、全生命周期监管转变。以此为契机,中国2万亿药品市场将实现重置。
与国际接轨
创新药标准提升更强调临床价值
可以看到,9份征求意见稿中,关于化药、生物药和中药的注册分类及申报要求等都给出了更加具体的规定。
特别值得注意的是,其中针对化药、生物药、中药创新药,做出了新的定义,将中国的创新药提升到了新的高度,临床价值成为重要的衡量标准。
在化药领域,新药分为创新药和改良型新药,必须是境内外未上市的药品,且具有临床价值。
对于生物药,分类在原有预防用、治疗用的基础上,增加了按生物质平管理的体外诊断试剂,同时,对改良剂型、改变给药途径、剂量等一秒、生物制品,要求必须具有明显临床优势。
对中药的创新药,也有对临床价值的强调。其中包括中药复方制剂、从单一动植物矿物等中提取得到的提取物及其制剂,以及新药材及其制剂。按照要求,中药的新药研发须更加重视临床评估,满足尚未满足的临床需求。
而改剂型、给药途径、增加适应症的产品也列入了改良型新药范畴。这被认为将促进中药产业对老药的进一步开发。
事实上,针对药品注册分类的改革早在2016年就已经启动了。这也被认为是药品审评审批制度改革推进的关键,对鼓励药品研发创新、提高质量有重要的意义。
新的药品注册配套文件在此前改革的基础上,根据新修订的《药品注册管理办法》,结合此前改革经验,进行了细化明确,同时,兼顾与药物研发技术指导原则等文件的紧密衔接,按照设计,未来将在审评审批体系中起到承上启下的作用。
此外,在资料申报过程中,要求所有药品上市、临床试验和原料药申请均按照CTD格式申报。而CTD格式是ICH(国际人用药品注册技术协调会)人用药物注册申请通用技术文档。国家药监局此举也进一步加强中国创新药与国际标准接轨。
这不仅将进一步加快境外创新药进入中国的速度,也有利于中国创新药走出国门。
规范中药管理
中药注射剂千亿市场洗牌来了
在此次征求意见的《中药注册管理专门规定(征求意见稿)》中,对中药注射剂的研制也提出了规范要求,包括中药注射剂研制须符合注射剂研究的通用技术要求,药物活性成分及作用机理须明确,并且要开展充分的非临床安全性研究。
这也意味着,中药注射剂已经告别特殊时期的“优待”,将按照注射剂标准受到更加严格、规范的管理。
结合上述征求意见稿中,关于如果中药上市五年后其说明书中的禁忌、不良反应、注意事项中任何一项还是“尚不明确”,将不予再注册的要求,相关产品将面临上市后评价的考验。
中药注射剂作为中国特有的品类,在此前相当长一段时间里,因为缺乏临床数据支持饱受诟病。一项早年由浙江丽水市人民医院医生主导的,针对30种中药注射剂说明书的调查显示,涉及的产品中,只有4种有具体的临床试验描述。
在此基础上,中药注射剂的不良反应事件/报告数量也居高不下,还曾发生过“鱼腥草注射液致人亡”事件、喜炎平、红花注射液被紧急叫停等轰动业界的大事件。其中由“热原”引起的过敏反应也被认为是中药注射剂难以摆脱的“原罪”。
尽管如此,中药注射剂的销售额连年走高,到2016年,只有100多个品种的中药注射剂,市场规模已经突破了千亿元大关。
近年来,随着临床控费、加强合理用药等政策的推行,中药注射剂遭到了来自重点监控、医保支付等多方面的限制,市场已经出现萎缩。
而按照2017年中办、国办发布“鼓励药械创新36条”所说,针对中药注射剂安全、有效性的再评价也将给中药注射剂最致命的一击。
虽然注射剂的上市后再评价并没有明确落实,但是以新监管模式,对所有药品须开展上市后再评价和强调充分的非临床安全性研究为基础,这一品类产品的洗牌也将进入实质性阶段。
可以看到,过敏试验、刺激性试验、溶血性试验等中药注射剂常见问题,都是非临床安全性试验的重要内容。
完善退出机制
明确五种情况药品将无法再注册
在药品再注册相关规定征求意见稿中,针对境内、境外生产药品提出了5种不予再注册的情况。
具体包括↓
也就是说以再注册为契机大批药品将面临淘汰。
特别是须通过一致性评价的仿制药,按照相关要求,自首家品种通过一致性评价后,其他药品生产企业的相同品种原则上应在3年内完成一致性评价。逾期未完成,又不属于临床必需,市场短缺的品种,将面临不予再注册,最终退市的命运。
图/ 视觉中国
自上世纪80年代以来,中国医药市场实现了快速发展。根据商务部统计数据,2017年全国医药市场总规模已经超过2万亿元。国家药监局官方数据显示,国产药品批文号达到了16万余个。
然而,在繁荣背后,由于没有退出机制,实际上很多长期不生产的药品批文未注销,很多在国外已经被禁止或限制儿童使用的药品,仍然在中国市场畅行无阻。这既不利于产业发展,也增加了用药风险。
更重要的是,按照新修订《药品管理法》要求,疗效不确切、不良反应大或者因其他原因危害人体 健康 的药品,将被注销药品注册证书。
此外,《疫苗生产流通管理规定》(征求意见稿)也就疫苗的准入、生产许可申请、委托生产,以及生产过程控制等做出了严格的要求。药监部门的巡查、检查频次和力度也将升级。
国家药监局将每年的对疫苗上市许可持有人每年开展一次疫苗巡查;省级药监部门将对委托生产企业检查两次,包括GMP符合性检查和对配送机构以及同级疾病预防控制机构的检查;市县也将对同级疾控机构、疫苗接种单位进行检查。
一旦发现问题,按照《疫苗管理法》的要求,将受到最高可达生产销售货值30倍到50倍的重罚。
毫无疑问,随着《药品管理法》、《疫苗管理法》,以及相关配套文件的不断发布、实施,中国医药市场的变革也将越来越深刻。
END
药品申报,参考
药品注册管理办法
28号令
CTD格式这些东西,你去药品审评中心去下载,里面有。
CTD化学药品CTD格式申报资料撰写要求-国食药监注[2010]387号 附件.doc
CTD格式申报资料撰写格式(原料药).doc
CTD格式申报主要研究信息汇总表(制剂).doc
CTD格式申报资料撰写格式(制剂).doc
CTD文件格式-电子档和纸质.doc
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。